Формула гексафторид серы: 404 — страница не найдена
Гексафторид серы — Sulfur hexafluoride
Greenhouse gas
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гексафторид серы | |||
| Систематическое название ИЮПАК Гексафтор-λ 6 -сульфан | |||
| Другие названия
Elagas Эсафлон фторид | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.018.050 | ||
| Номер ЕС | |||
| 2752 | |||
| КЕГГ | |||
| MeSH | Сера + гексафторид | ||
| Номер RTECS | |||
| UNII | |||
| Номер ООН | 1080 | ||
| |||
| Характеристики | |||
| SF 6 | |||
| Молярная масса | 146,06 г / моль | ||
| Появление | Бесцветный газ | ||
| Запах | без запаха | ||
| Плотность | 6,17 г / л | ||
| Температура плавления | −64 ° С; -83 ° F; 209 К | ||
| Точка кипения | -50,8 ° С (-59,4 ° F, 222,3 К) | ||
| Критическая точка ( T , P ) | 45,51 ± 0,1 ° С , 3,749 ± 0,01 МПа | ||
| 0,003% (25 ° С) | |||
| Растворимость | мало растворим в воде, хорошо растворим в этаноле, гексане, бензоле | ||
| Давление газа | 2,9 МПа (при 21,1 ° C) | ||
| −44,0 × 10 −6 см 3 / моль | |||
| Теплопроводность |
| ||
| Вязкость | 15,23 мкПа · с | ||
| Состав | |||
| Ромбическая , oP28 | |||
| О ч | |||
| Ортогональный гексагональный | |||
| Восьмигранный | |||
| 0 Д | |||
| Термохимия | |||
| 0,097 кДж / (моль · К) (постоянное давление) | |||
| 292 Дж · моль −1 · K −1 | |||
| -1209 кДж · моль -1 | |||
| Фармакология | |||
| V08DA05 ( ВОЗ ) | |||
| Данные лицензии | |||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материала | ||
| S-фразы Replaced by GHS data»> (устаревшие) | S38 | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
| TWA 1000 частей на миллион (6000 мг / м 3 ) | |||
| REL (рекомендуется) | TWA 1000 частей на миллион (6000 мг / м 3 ) | ||
| IDLH (Непосредственная опасность) | ND | ||
| Родственные соединения | |||
Родственные фториды серы | Декафторид дисеры Тетрафторид серы | ||
Родственные соединения | Гексафторид селена Сульфурилфторид | ||
| Y проверить ( что есть ?) YN | |||
| Ссылки на инфобоксы | |||
Chemical compound
Гексафторид серы (SF 6 ) или гексафторид серы ( британское написание ) — это чрезвычайно мощный и стойкий парниковый газ, который в основном используется в качестве электроизолятора и средства подавления дуги . Он неорганический , бесцветный, без запаха, негорючий и нетоксичный. SF
6 имеет октаэдрическую геометрию , состоящую из шести атомов фтора, присоединенных к центральному атому серы . Это гипервалентная молекула .
Типичный для неполярного газа SF
6 плохо растворим в воде, но вполне растворим в неполярных органических растворителях. Его плотность на уровне моря составляет 6,12 г / л, что значительно выше плотности воздуха (1,225 г / л). Обычно он транспортируется как сжиженный сжатый газ .
Обычно он транспортируется как сжиженный сжатый газ .
Концентрация SF
6 в тропосфере Земли достигла 10 частей на триллион (ppt) в 2019 году, увеличившись на 0,35 ppt / год. Увеличение по сравнению с предыдущими 40 годами в значительной степени было вызвано расширением сектора электроэнергетики, включая неорганизованные выбросы из банков SF.
6 газ, содержащийся в распределительном устройстве среднего и высокого напряжения . Использование в производстве магния, алюминия и электроники также ускорило рост атмосферы.
Синтез и реакции
Гексафторид серы на Земле существует в основном как промышленный газ, созданный руками человека, а также обнаружено, что он встречается в естественных условиях.
SF
6 можно приготовить из элементов путем экспонирования S
8 к F
2 . Этот же метод использовали первооткрыватели Анри Муассан и Поль Лебо в 1901 году. Некоторые другие фториды серы образуются совместно, но их удаляют нагреванием смеси, чтобы диспропорционировать любую S
2 F
10 (который очень токсичен), а затем очистить продукт с помощью NaOH, чтобы разрушить оставшийся SF
4 .
В качестве альтернативы, используя бром , гексафторид серы можно синтезировать из SF 4 и CoF 3 при более низких температурах (например, 100 ° C) следующим образом:
2 CoF 3 + SF 4 + [Br 2 ] → SF 6 + 2 CoF 2 + [Br 2 ]
Химия реакции для SF практически отсутствует.
6 . Основным вкладом в инертность SF 6 является стерическое затруднение атома серы, тогда как его более тяжелые аналоги из группы 16, такие как SeF 6 , более реакционноспособны, чем SF 6, в результате меньшего стерического затруднения (см. Пример гидролиза). Он не реагирует с расплавленным натрием ниже его точки кипения, но экзотермически реагирует с литием .
Пример гидролиза). Он не реагирует с расплавленным натрием ниже его точки кипения, но экзотермически реагирует с литием .
Приложения
В электроэнергетике использовалось около 80% гексафторида серы, произведенного в 2000 году, в основном в качестве газообразной диэлектрической среды . Другие основные применения по состоянию на 2015 год включали кремниевый травитель для производства полупроводников и инертный газ для литья магния .
Диэлектрическая среда
SF
6 используется в электротехнической промышленности в качестве газообразной диэлектрической среды для высоковольтных выключателей из гексафторида серы , распределительных устройств и другого электрического оборудования, часто заменяя масляные выключатели (OCB), которые могут содержать вредные полихлорированные дифенилы (ПХБ). SF
6 Газ под давлением используется в качестве изолятора в распределительных устройствах с элегазовой изоляцией (GIS), поскольку он имеет гораздо более высокую диэлектрическую прочность, чем воздух или сухой азот . Высокая диэлектрическая прочность является результатом высокой электроотрицательности и плотности газа . Это свойство позволяет значительно уменьшить габариты электрооборудования. Это делает КРУЭ более подходящими для определенных целей, таких как размещение в помещении, в отличие от электрического оборудования с воздушной изоляцией, которое занимает значительно больше места. Электрический редуктор с газовой изоляцией также более устойчив к воздействию загрязнения и климата, а также более надежен в долгосрочной эксплуатации благодаря контролируемой рабочей среде. Воздействие дуги химически разрушает SF
6 хотя большинство продуктов разложения имеют тенденцию быстро восстанавливать SF
6 , процесс, называемый «самовосстановлением». Дуга или коронный разряд могут привести к образованию декафторида дисеры ( S
2 F
10 ), высокотоксичный газ, сравнимый по токсичности с фосгеном .
 S
S 2 F
10 считался потенциальным боевым химическим веществом во время Второй мировой войны, потому что он не вызывает слезотечения или раздражения кожи, поэтому мало предупреждает о воздействии.
SF
6 также часто встречается в качестве высоковольтного диэлектрика в источниках высокого напряжения ускорителей частиц , таких как генераторы Ван де Граафа и пеллетроны, и высоковольтные просвечивающие электронные микроскопы .
| Найдите фторкетон в Викисловаре, бесплатном словаре. |
Альтернативы SF
6 В качестве диэлектрического газа включают несколько фторкетонов.
Медицинское использование
6 используется для тампонады или закрытия отверстия сетчатки при операциях по восстановлению отслойки сетчатки в виде газового пузыря. Он инертен в камере стекловидного тела и первоначально удваивает свой объем за 36 часов, а затем всасывается в кровь через 10–14 дней.
SF
6 используется в качестве контрастного вещества для ультразвуковой визуализации. Микропузырьки гексафторида серы вводятся в виде раствора путем инъекции в периферическую вену. Эти микропузырьки улучшают видимость кровеносных сосудов для ультразвукового исследования. Это приложение использовалось для исследования васкуляризации опухолей. Он остается видимым в крови от 3 до 8 минут и выдыхается легкими.
Изотопный состав
Гексафторид серы был индикаторным газом, использованным при калибровке первой модели рассеивания воздуха на проезжей части дороги ; Эта исследовательская программа спонсировалась Агентством по охране окружающей среды США и проводилась в Саннивейле, Калифорния, на шоссе 101 США . Газообразный SF
6 используется в качестве индикаторного газа в краткосрочных экспериментах по оценке эффективности вентиляции в зданиях и закрытых помещениях, а также для определения скорости инфильтрации . Два основных фактора рекомендуют его использование: его концентрация может быть измерена с удовлетворительной точностью при очень низких концентрациях, а в атмосфере Земли концентрация SF пренебрежимо мала.
Два основных фактора рекомендуют его использование: его концентрация может быть измерена с удовлетворительной точностью при очень низких концентрациях, а в атмосфере Земли концентрация SF пренебрежимо мала.
6 .
Гексафторид серы использовался в качестве нетоксичного тестового газа в эксперименте на станции метро St. John’s Wood в Лондоне , Соединенное Королевство, 25 марта 2007 года. Газ был выпущен по всей станции и контролировался по мере его распространения. Целью эксперимента, о котором ранее в марте объявил государственный секретарь по транспорту Дуглас Александер , было исследование того, как токсичный газ может распространиться по станциям и зданиям лондонского метрополитена во время террористической атаки.
Гексафторид серы также обычно используется в качестве индикаторного газа при испытаниях герметичности вытяжных шкафов в лабораториях. Газ используется на заключительном этапе аттестации вытяжного шкафа ASHRAE 110. Внутри вытяжного шкафа образуется шлейф газа, и проводится серия тестов, в то время как газоанализатор, расположенный за пределами вытяжного шкафа, отбирает SF 6 для проверки герметичности вытяжного шкафа.
Он успешно использовался в качестве индикатора в океанографии для изучения диапикнического перемешивания и газообмена между воздухом и морем.
Другое использование
- ВМС США «ы Марк 50 торпеда закрыта Ренкина цикл двигательная система питается от гексафторида серы в экзотермической реакции с твердым литием .
- SF
6 Плазма также используется в полупроводниковой промышленности в качестве травителя в таких процессах, как глубокое реактивно-ионное травление . Небольшая часть SF
6 распадается в плазме на серу и фтор, а ионы фтора вступают в химическую реакцию с кремнием. - В магниевой промышленности используется большое количество SF.

6 в качестве инертного газа для заполнения литейных форм. - Повышает давление в волноводах в мощных микроволновых системах. Газ изолирует волновод, предотвращая возникновение внутренней дуги.
- Используется в электростатических громкоговорителях из-за своей высокой диэлектрической прочности и высокой молекулярной массы.
- С 1992 по 2006 год использовался для наполнения подушек безопасности Nike Air во всей их обуви.
- Сырье для производства декафторида дисеры химического оружия .
- Для развлекательных целей, когда дышится, SF
6 заставляет голос становиться значительно глубже из-за того, что его плотность намного выше, чем у воздуха, как видно на этом видео . Это связано с более известным эффектом вдыхания гелия низкой плотности , из-за которого чей-то голос становится намного выше. Оба этих эффекта следует предпринимать с осторожностью, поскольку эти газы вытесняют кислород, который легкие пытаются извлечь из воздуха. Гексафторид серы также обладает слабым обезболивающим действием. - Для научных демонстраций / магии как «невидимая вода», поскольку легкая лодка из фольги может плавать в резервуаре, как и воздушный шар, наполненный воздухом.
Парниковый газ
Численность и скорость роста SF6 в тропосфере Земли (1978-2018). Атмосферная концентрация SF 6 в сравнении с аналогичными техногенными газами (правый график). Обратите внимание на масштаб журнала.
По данным Межправительственной группы экспертов по изменению климата , SF
6 является наиболее сильным парниковым газом , который был оценен, с потенциалом глобального потепления в 23900 раз выше, чем у CO.
2 при сравнении за 100-летний период. Гексафторид серы инертен в тропосфере и стратосфере и является чрезвычайно долгоживущим, по оценкам, время жизни в атмосфере составляет 800–3200 лет.
Измерения SF 6 показывают, что его глобальный средний коэффициент смешивания увеличился с постоянного базового уровня около 54 частей на квадриллион до индустриализации до более 10 частей на триллион (частей на миллион) по состоянию на апрель 2020 года и увеличивается примерно на 0,35 частей на триллион (3,5 процентов) в год. Средние глобальные концентрации SF 6 увеличивались примерно на семь процентов в год в течение 1980-х и 1990-х годов, в основном в результате его использования в производстве магния , а также производителями электрооборудования и электроники. Учитывая небольшое количество выделяемого SF 6 по сравнению с углекислым газом , его общий индивидуальный вклад в глобальное потепление оценивается менее 0,2 процента, однако коллективный вклад этого и аналогичных антропогенных галогенизированных газов достиг примерно 10 процентов за год. 2020. Альтернативы тестируются.
В Европе SF
6 подпадает под действие директивы по фторсодержащим газам, которая запрещает или контролирует их использование для нескольких приложений. С 1 января 2006 года, Сан — Франциско
6 запрещен как индикаторный газ и во всех приложениях, кроме высоковольтных распределительных устройств . В 2013 году сообщалось, что трехлетние усилия Министерства энергетики США по выявлению и устранению утечек в его лабораториях в США, таких как Принстонская лаборатория физики плазмы , где газ используется в качестве изолятора высокого напряжения, привели к были продуктивными, сократив годовые утечки на 1 030 кг (2280 фунтов). Это было сделано путем сравнения покупок с инвентарными запасами, предполагая, что разница была утечкой, а затем обнаружение и устранение утечек.
Физиологические эффекты и меры предосторожности
Как и ксенон , гексафторид серы является нетоксичным газом, но, вытесняя кислород в легких, он также несет риск асфиксии при вдыхании слишком большого количества. Поскольку он более плотный, чем воздух, значительное количество газа при выходе оседает в низинных областях и представляет значительный риск удушья при входе в эту зону. Это особенно актуально для его использования в качестве изолятора в электрическом оборудовании, поскольку рабочие могут находиться в траншеях или ямах под оборудованием, содержащим SF.
Поскольку он более плотный, чем воздух, значительное количество газа при выходе оседает в низинных областях и представляет значительный риск удушья при входе в эту зону. Это особенно актуально для его использования в качестве изолятора в электрическом оборудовании, поскольку рабочие могут находиться в траншеях или ямах под оборудованием, содержащим SF.
6 .
Как и для всех газов, плотность SF
6 влияет на резонансные частоты речевого тракта, тем самым резко меняя звуковые качества голоса или тембр тех, кто его вдыхает. Не влияет на колебания голосовых связок. Плотность гексафторида серы относительно высока при комнатной температуре и давлении из-за большой молярной массы газа . В отличие от гелия , который имеет молярную массу около 4 г / моль и повышает голос, SF
6 имеет молярную массу около 146 г / моль, а скорость звука через газ составляет около 134 м / с при комнатной температуре, понижая тембр голоса. Для сравнения, молярная масса воздуха, состоящего примерно из 80% азота и 20% кислорода, составляет примерно 30 г / моль, что приводит к скорости звука 343 м / с.
Гексафторид серы обладает анестезирующим действием немного ниже, чем закись азота ; Гексафторид серы относится к категории слабых анестетиков.
Смотрите также
использованная литература
дальнейшее чтение
внешние ссылки
Гексафторид серы
Парниковый газ
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гексафторид серы | |||
| Систематическое название ИЮПАКГексафтор-λ6-сульфан[1] | |||
| Другие именаElagas Эсафлон | |||
| Идентификаторы | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.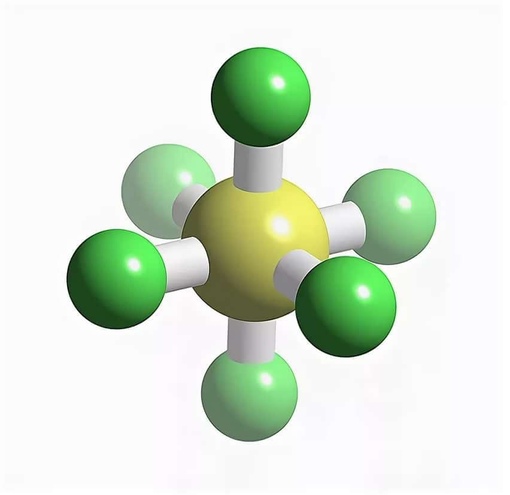 018.050 018.050 | ||
| Номер ЕС | |||
| 2752 | |||
| КЕГГ | |||
| MeSH | Сера + гексафторид | ||
| Номер RTECS | |||
| UNII | |||
| Номер ООН | 1080 | ||
| |||
| Характеристики | |||
| SF6 | |||
| Молярная масса | 146,06 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | без запаха[2] | ||
| Плотность | 6,17 г / л | ||
| Температура плавления | −64 ° С; -83 ° F; 209 К | ||
| Точка кипения | -50,8 ° С (-59,4 ° F, 222,3 К) | ||
| Критическая точка (Т, п) | 45.51±0,1 ° С, 3.749±0,01 МПа[3] | ||
| 0,003% (25 ° С)[2] | |||
| Растворимость | мало растворим в воде, хорошо растворим в этаноле, гексане, бензоле | ||
| Давление газа | 2,9 МПа (при 21,1 ° C) | ||
| −44.0×10−6 см3/ моль | |||
| Теплопроводность |
| ||
| Вязкость | 15,23 мкПа · с[5] | ||
| Структура | |||
| Орторомбический, oP28 | |||
| Очас | |||
| Ортогональный шестиугольник | |||
| Восьмигранный | |||
| 0 Д | |||
| Термохимия | |||
| 0,097 кДж / (моль · К) (постоянное давление) | |||
| 292 Дж · моль−1· K−1[6] | |||
| -1209 кДж · моль−1[6] | |||
| Фармакология | |||
| V08DA05 (ВОЗ) | |||
| Данные лицензии | |||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
| S-фразы Заменено данными GHS»>(устарело) | S38 | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (Пределы воздействия на здоровье в США): | |||
| TWA 1000 частей на миллион (6000 мг / м3)[2] | |||
| REL (Рекомендуемые) | TWA 1000 частей на миллион (6000 мг / м3)[2] | ||
| IDLH (Непосредственная опасность) | N.D.[2] | ||
| Родственные соединения | |||
Родственные фториды серы | Декафторид дисеры Тетрафторид серы | ||
Родственные соединения | Гексафторид селена Сульфурилфторид | ||
| Y проверять (что YN ?) | |||
| Ссылки на инфобоксы | |||
Гексафторид серы (SF6) или же гексафторид серы (Британская орфография), является чрезвычайно мощным и стойким искусственным парниковый газ который в основном используется как электрический изолятор и дугогаситель.[7] это неорганический, без цвета, без запаха, безлегковоспламеняющийся, и нетоксичен. SF
6 имеет октаэдрическая геометрия, состоящий из шести фтор атомы, прикрепленные к центральному сера атом. Это гипервалентная молекула.
Типично для неполярный газ SF
6 плохо растворимый в воде, но хорошо растворяется в неполярных органических растворителях. Он имеет плотность 6,12 г / л на уровне моря, что значительно выше, чем у плотность воздуха (1,225 г / л). Обычно его транспортируют как сжиженный сжатый газ.
Синтез и реакции
SF
6 можно приготовить из элементов путем воздействия S
8 к F
2. Этот же метод использовали первооткрыватели. Анри Муассан и Поль Лебо в 1901 году. Некоторые другие фториды серы образуются вместе, но они удаляются путем нагревания смеси до непропорционально любой S
Этот же метод использовали первооткрыватели. Анри Муассан и Поль Лебо в 1901 году. Некоторые другие фториды серы образуются вместе, но они удаляются путем нагревания смеси до непропорционально любой S
2F
10 (который очень токсичен), а затем очистите продукт NaOH уничтожить оставшиеся SF
4.
В качестве альтернативы, используя бром, гексафторид серы можно синтезировать из SF4 и CoF3 при более низких температурах (например, 100 ° C), а именно:[8]
2 CoF3 + SF4 + [Br2] → SF6 + 2 CoF2 + [Br2]
Практически отсутствует химия реакции для SF
6. Главный вклад в инертность SF6 это стерическое препятствие атома серы, тогда как его более тяжелые аналоги из группы 16, такие как SeF6 более реактивны, чем SF6 в результате меньших стерических затруднений (см. пример гидролиза).[9] Не реагирует с расплавом натрий ниже точки кипения,[10] но реагирует экзотермически с литий.
Парниковый газ
Таймсерии гексафторида серы Мауна-Лоа. Атмосферная концентрация SF6 в сравнении с аналогичными техногенными газами (правый график). Обратите внимание на масштаб журнала.Согласно межправительственная комиссия по изменению климата, SF
6 самый мощный парниковый газ что он оценил, с потенциал глобального потепления в 23 900 раз больше, чем CO
2 при сравнении за 100-летний период.[11] Гексафторид серы инертен в тропосфера и стратосфера и чрезвычайно долговечен, по оценкам время жизни в атмосфере 800–3200 лет.[12]
Измерения SF6 показать, что его среднемировой соотношение смешивания достигла более 10 частей на триллион (п.п.) по состоянию на апрель 2020 года и увеличивается примерно на 0,35 п.п. (3,5 процента) в год.[13][14] Средний глобальный SF6 концентрация увеличивалась примерно на семь процентов в год в течение 1980-х и 1990-х годов, в основном в результате его использования в магний производства, а также производителями электрооборудования и электроники. Учитывая небольшое количество SF6 выпущен по сравнению с углекислый газ, ее общий индивидуальный вклад в глобальное потепление оценивается менее 0,2 процента,[15] однако коллективный вклад этого и аналогичных техногенных галогенизированных газов достиг примерно 10 процентов по состоянию на 2020 год.[16] Альтернативы тестируются.[17]
Учитывая небольшое количество SF6 выпущен по сравнению с углекислый газ, ее общий индивидуальный вклад в глобальное потепление оценивается менее 0,2 процента,[15] однако коллективный вклад этого и аналогичных техногенных галогенизированных газов достиг примерно 10 процентов по состоянию на 2020 год.[16] Альтернативы тестируются.[17]
В Европе, SF
6 подпадает под Фторсодержащий газ директива, которая запрещает или контролирует ее использование для нескольких приложений.[7] С 1 января 2006 г. SF
6 запрещен как индикаторный газ и во всех приложениях, кроме распределительное устройство высокого напряжения.[18] В 2013 году сообщалось, что трехлетние усилия Министерство энергетики США для выявления и устранения утечек в своих лабораториях в США, таких как Принстонская лаборатория физики плазмы, где газ используется как изолятор высокого напряжения, оказалась продуктивной, сократив ежегодные утечки на 1 030 кг (2 280 фунтов). Это было сделано путем сравнения покупок с инвентарными запасами, предполагая, что разница была утечкой, а затем обнаружение и устранение утечек.[19]
Приложения
Более 10 000 тонн SF
6 производятся в год, большая часть из которых (более 8000 тонн) используется как газообразная диэлектрическая среда в электротехническая промышленность.[20] Другие основные применения включают инертный газ для кастинга магний, и как инертная начинка для изоляционное остекление окна.
Диэлектрическая среда
SF
6 используется в электротехническая промышленность как газообразная диэлектрическая среда для высокого напряжения Автоматические выключатели, распределительное устройство, и другие электрические оборудование, часто заменяющее маслонаполненные выключатели (OCB), которые могут содержать вредные Печатные платы. SF
6 газ под давление используется как изолятор в распределительное устройство с газовой изоляцией (ГИС), потому что он имеет гораздо более высокую диэлектрическая прочность чем воздуха или сушить азот. Высокая диэлектрическая прочность является результатом высокого давления газа. электроотрицательность и плотность. Это свойство позволяет значительно уменьшить габариты электропривода. Это делает КРУЭ более подходящими для определенных целей, таких как размещение в помещении, в отличие от электрического оборудования с воздушной изоляцией, которое занимает значительно больше места. Электроприводы с газовой изоляцией также более устойчивы к воздействию загрязнения и климата, а также более надежны в долгосрочной эксплуатации благодаря контролируемой рабочей среде. Воздействие дуги химически разрушает SF
Высокая диэлектрическая прочность является результатом высокого давления газа. электроотрицательность и плотность. Это свойство позволяет значительно уменьшить габариты электропривода. Это делает КРУЭ более подходящими для определенных целей, таких как размещение в помещении, в отличие от электрического оборудования с воздушной изоляцией, которое занимает значительно больше места. Электроприводы с газовой изоляцией также более устойчивы к воздействию загрязнения и климата, а также более надежны в долгосрочной эксплуатации благодаря контролируемой рабочей среде. Воздействие дуги химически разрушает SF
6 хотя большинство продуктов разложения имеют тенденцию быстро переформировываться SF
6, процесс, называемый «самовосстановлением».[21]Дуга или же корона может производить декафторид дисеры (S
2F
10), весьма токсичный газ, с токсичностью, аналогичной фосген. S
2F
10 считался потенциальным химическая война агент в Вторая Мировая Война потому что он не производит слезотечение или раздражение кожи, что практически не предупреждает о воздействии.
SF
6 также часто встречается в качестве диэлектрика высокого напряжения в источниках высокого напряжения ускорители частиц, Такие как Генераторы Ван де Граафа и Пеллетроны и передача высокого напряжения электронные микроскопы.
| Искать фторкетон в Викисловаре, бесплатном словаре. |
Альтернативы SF
6 В качестве диэлектрического газа включают несколько фторкетонов.[22][23]
Медицинское использование
SF
6 используется для обеспечения тампонада или заткнуть отверстие сетчатки в отслойка сетчатки ремонтные работы[24] в виде газового пузыря. Он инертен в стекловидное тело[25] и первоначально его объем удваивается за 36 часов, а затем он всасывается в кровь через 10–14 дней. [26]
[26]
SF
6 используется как контрастное вещество для УЗИ визуализация. Микропузырьки гексафторида серы вводятся в виде раствора путем инъекции в периферическую вену. Эти микропузырьки улучшают видимость кровеносных сосудов для ультразвукового исследования. Это приложение использовалось для исследования васкуляризации опухолей.[27] Он остается видимым в крови от 3 до 8 минут и выдыхается легкими.[28]
Изотопный состав
Гексафторид серы был индикаторный газ использовался в первом модель рассеивания воздуха на проезжей части калибровка; эта исследовательская программа спонсировалась Агентство по охране окружающей среды США и проводился в Саннивейл, Калифорния на США шоссе 101.[29] Газообразный SF
6 используется как индикаторный газ в краткосрочных экспериментах вентиляция эффективность в зданиях и закрытых помещениях, а также для определения проникновение тарифы. Два основных фактора рекомендуют его использование: его концентрация может быть измерена с удовлетворительной точностью при очень низких концентрациях, и Атмосфера Земли имеет незначительную концентрацию SF
6.
Гексафторид серы использовался в качестве нетоксичного тестового газа в эксперименте при Станция метро St. John’s Wood в Лондон, Соединенное Королевство 25 марта 2007 г.[30] Газ был выпущен по всей станции и контролировался по мере его распространения. Цель эксперимента, о котором ранее в марте объявили Государственный секретарь по транспорту Дуглас Александр, было выяснить, как токсичный газ может распространяться по Лондонское метро вокзалы и здания во время теракта.
Гексафторид серы также обычно используется в качестве индикаторного газа в лабораторных испытаниях герметичности вытяжных шкафов. Газ используется на заключительном этапе ASHRAE 110 квалификация вытяжного шкафа. Внутри вытяжного шкафа образуется шлейф газа, и проводится серия тестов, в то время как газоанализатор, расположенный за пределами вытяжного шкафа, отбирает образцы SF. 6 для проверки герметичности вытяжного шкафа.
6 для проверки герметичности вытяжного шкафа.
Он успешно использовался как трассер в океанография учиться диапикальный смешивание и обмен газов воздух-море.
Другое использование
- В ВМС СШАс Торпеда Марк 50 закрыто Цикл Ренкина двигательная установка приводится в действие гексафторидом серы в экзотермическая реакция с твердым литий.[31]
- SF
6 плазма также используется в полупроводник промышленность как травить. Небольшая часть SF
6 распадается в плазме на серу и фтор, а ионы фтора вступают в химическую реакцию с кремнием.[32] - В магний промышленность использует большое количество SF
6 в качестве инертного газа для заполнения литейных форм.[33] - Создает давление волноводы в большой мощности микроволновая печь системы. Газ изолирует волновод, предотвращая внутреннюю дугу.
- Использовался в электростатические громкоговорители из-за его высокой диэлектрической прочности и высокой молекулярной массы.[34]
- Используется для наполнения подушек безопасности Nike Air во всей их обуви с 1992 по 2006 год.[35]
- Сырье для производства химическое оружие декафторид дисеры.
- В развлекательных целях, когда дышишь, SF
6 заставляет голос становиться значительно глубже из-за того, что его плотность намного выше, чем у воздуха, как видно на это видео. Это связано с более известным эффектом дыхания низкой плотности. гелий, из-за чего чей-то голос становится намного выше. Оба этих эффекта следует применять только с осторожностью, поскольку эти газы вытесняют кислород что легкие пытаются извлечь из воздуха. Гексафторид серы также обладает слабым обезболивающим действием.[36] - Для научных демонстраций / магии как «невидимая вода», поскольку легкая лодка из фольги может плавать в резервуаре, как и воздушный шар, наполненный воздухом.
Физиологические эффекты и меры предосторожности
Нравиться ксенон, гексафторид серы — нетоксичный газ, но, вытесняя кислород в легких, он также несет риск асфиксия если вдыхается слишком много. Weaver, Raymond H .; Добродетель, Роберт В. (1 ноября 1952 г.). «Мягкие анестезирующие свойства гексафторида серы». Анестезиология. 13 (6): 605–607. Дои:10.1097/00000542-195211000-00006. PMID 12986223. S2CID 32403288.
Weaver, Raymond H .; Добродетель, Роберт В. (1 ноября 1952 г.). «Мягкие анестезирующие свойства гексафторида серы». Анестезиология. 13 (6): 605–607. Дои:10.1097/00000542-195211000-00006. PMID 12986223. S2CID 32403288.
дальнейшее чтение
внешняя ссылка
| Известные бинарные гексафториды | |||||||
|---|---|---|---|---|---|---|---|
| Прогнозируемые бинарные гексафториды |
| ||||||
| BF4− соединения | |
|---|---|
| ПФ6−, AsF6−, SbF6− соединения | |
| AlF6−, AsF6−, SbF6− соединения | |
| хлориды, бромиды, йодиды и псевдогалогениды | |
| SiF62-, GeF62- соединения | |
| Оксифториды | |
| Органофториды | |
| с переходным металлом, лантаноидом, актинидом, аммонием | |
| азотные кислоты | |
| бифториды | |
| тионил, фосфорил и иодозил | |
Элегаз свойства и применение
Элегаз является бесцветным энертным тяжелым газом, не имеющим запаха. Он не взрывоопасен, не горюч и не токсичен, при температуре 20 С и нормальном давлении не образует агрессивную среду, в пять раз тяжелее воздуха.
С химической точки зрения элегаз представляет собой гексафторид серы (шестифтористая сера, SF6. Вещество не стареет, оно даже со временем не теряет своих первоначальных качеств. В результате электрического разряда происходит распад элегаза, но он быстро рекомбинирует. Данный процесс является обратным ионизации и восстанавливает изначальную диэлектрическую прочность. Поэтому вещество часто используется в качестве изоляционного материала, применяется при создании коммутационного оборудования, которое функционирует при напряжении 35 кВ и больше.
| ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ | |
Молекулярная масса | 146,06 г/моль |
Температура сублимации | -63,80 С |
Критическая температура | 45,6 °С |
Критическое давление | 3,76 МПа |
Критическая плотность | 740 кг/м3 |
Температура плавления (при 0,227 МПа) | -50,8 °С |
Данные по окружающей среде | |
ODP(Озоноразрушающий потенциал) | 0 |
GWP | 24900 |
ПДК р.з. | 5000 мг/м3 |
Элегаз – востребованное соединение
Высокие номинальные напряжения и ток приводят к тому, что при создании оборудования возникают проблемы. Они связаны с высоким давлением воздуха, что обуславливает необходимость значительных затрат на обеспечение механической прочности устройств.
Рациональным решением этой задачи является использование специального газа вместо воздуха. Такое вещество должно характеризоваться большей электрической прочностью и способностью отключения. Элегаз стал оптимальным выбором для этой цели.
Характеристики элегаза, основные преимущества
Основные свойства элегаза:
- значительная удельная теплоемкость, превышающая аналогичную характеристику воздуха в четыре раза, что позволяет снизить количество меди в оборудовании и увеличить нагрузку на токоведущие части;
- электрическая прочность превышает в 2,5 раза атмосферные показатели; если говорить о давлении 0,2 Мпа, то газ становится близким по качеству к трансформаторному маслу;
- с элегазом номинальный ток отключения камеры продольного дутья в 5 раз больше по сравнению с воздухом;
- в столбе дуги малая напряженность электрического поля; это способствует сокращению закупорки, снижая термодинамический эффект, и помогает увеличить расстояние между контактами;
- элегаз не вступает в реакцию с кислородом, поскольку является инертным веществом; он слабо разлагается дугой;
- соединение нетоксично; продукты разложения могут быть опасны, но это случается редко.

Среди недостатков можно выделить высокую температуру снижения. Это не имеет значения при создании оборудования, работающего при 35 кВ и больше. Газ SF6 сегодня широко используется при изготовлении коммутационной аппаратуры, среди которой автоматические выключатели и контакторы. Такие устройства широко используются во всех схемах распределения электроэнергии.
Области применения элегаза
Преимуществ у элегаза настолько много и они так разнообразны, что это обусловило широту сферы его распространения. Помимо оборудования, функционирующего при 35 кВ и больше, вещество широко используется и в других направлениях, среди которых:
- медицинская сфера;
- научное оборудование;
- акустические системы;
- стеклопакеты;
- металлургическая обработка алюминия, других металлов и не только.
Обращайтесь к профессионалам
Компания «Империя» предлагает приобрести элегаз на привлекательных условиях. Мы готовы обеспечить своевременную поставку вещества. Чтобы сделать заказ элегаза, обращайтесь к нам на сайте онлайн или по телефону. Выбирайте наиболее удобный способ заказа и оплаты. Мы всегда к вашим услугам!
Парниковые газы: нужный, но опасный незнакомец | Научные открытия и технические новинки из Германии | DW
В середине декабря в Копенгагене пройдет 15-я международная конференция по проблеме климата. На ней должен быть согласован новый протокол к Рамочной конвенции ООН, призванный прийти на смену Киотскому и придать мощный импульс борьбе с глобальным потеплением. Этот протокол — так же, впрочем, как и его предшественник, — обяжет подписавшие его страны не только снизить до определенного уровня объемы эмиссии парниковых газов, но и вести их строгий учет.
Не только углекислый газ
В сознании рядового жителя нашей планеты понятие «парниковый газ» ассоциируется, прежде всего, с углекислым газом, затем — с метаном и с закисью азота, более известной под названием «веселящий газ». Именно эти три вещества возглавляют перечень парниковых газов, приведенный в приложении А к Киотскому протоколу, однако ими перечень подлежащих учету газов отнюдь не исчерпывается.
Именно эти три вещества возглавляют перечень парниковых газов, приведенный в приложении А к Киотскому протоколу, однако ими перечень подлежащих учету газов отнюдь не исчерпывается.
Теперь эксперты забили тревогу: они обнаружили весьма значительное расхождение между реальным содержанием в атмосфере одного из парниковых газов и тем количеством, о котором страны-участницы Киотского протокола официально доложили в Секретариат ООН по климату. Речь идет о соединении, занимающем последнее место в киотском перечне газов, выбросы которых подлежащих учету. Его химическая формула — SF6. Что же это за газ? «SF6 — это гексафторид серы, — говорит голландец Питер Танс (Pieter Tans), научный сотрудник лаборатории мониторинга и анализа климата Национального управления по океану и атмосфере США. — Думаю, большинство людей никогда даже не слышали такого названия».
Скорее всего, ученый прав. Между тем, это очень важный газ: он предотвращает пожары. «SF6 применяется для подавления искрообразования в высоковольтных электроустановках, — поясняет Питер Танс. — Если бы в трансформаторах, коммутационных устройствах и тому подобном электрооборудовании не было этого защитного газа, то при каждом переключении рубильника возникал бы пожар. Кроме того, SF6 используется в качестве защитного газа и при производстве магния, поскольку этот металл в процессе плавления легко воспламеняется».
Недостатки — продолжение достоинств
SF6 получил столь широкое применение потому, что он не ядовит и химически крайне инертен. Но эти достоинства являются и его крупными недостатками с точки зрения экологии. «В атмосфере этот газ практически не расщепляется, — говорит Питер Танс. — Средняя продолжительность жизни каждой его молекулы составляет, по меньшей мере, 1000 лет. По этой причине у этого газа огромный потенциал в смысле парникового эффекта и глобального потепления».
Понятно, почему SF6 входит в число «киотских» газов. Однако теперь Национальное управление по океану и атмосфере США, где анализируются данные 60 метеостанций, разбросанных по всему миру, пребывает в растерянности.:max_bytes(150000):strip_icc()/Sulfur-hexafluoride-unit-cell-3D-balls-5a9745b4ba6177003752cbbd.png) «Мы обнаружили, что в последнее время мировые объемы эмиссии SF6 выросли, — поясняет Питер Танс. — Между тем, по информации, представленной в ООН промышленно развитыми странами, эти объемы сокращаются. Тут что-то не так! Если суммировать все официально задекларированные выбросы, мы получим от силы 30 процентов того объема эмиссий, который мог бы объяснить реально наблюдаемую концентрацию SF6 в атмосфере».
«Мы обнаружили, что в последнее время мировые объемы эмиссии SF6 выросли, — поясняет Питер Танс. — Между тем, по информации, представленной в ООН промышленно развитыми странами, эти объемы сокращаются. Тут что-то не так! Если суммировать все официально задекларированные выбросы, мы получим от силы 30 процентов того объема эмиссий, который мог бы объяснить реально наблюдаемую концентрацию SF6 в атмосфере».
То ли утечки, то ли ищем не там…
Информацию, собранную американцами, подтверждают и японские ученые. Сходные данные получили и специалисты в области физики атмосферы из Гейдельбергского университета. Для объяснения обнаруженного феномена у специалистов есть всего две версии: либо из трансформаторов и плавильных печей промышленно развитых стран в атмосферу улетучивается больше газа, чем они об этом сообщают, либо источником выбросов являются вовсе не промышленно развитые, а развивающиеся страны и страны с переходной экономикой.
Скорее всего, тут играют роль оба фактора, — полагает Питер Танс: «Я не могу утверждать это со всей определенностью, но многое указывает на то, что подлинные масштабы утечки SF6 из промышленных установок недооценены, а потому и официальные данные, представляемые в ООН, сильно занижены. С другой стороны, большая часть выбросов SF6 приходится на долю Китая. Там идет стремительная электрификация, чуть ли не еженедельно вступают в строй новые электростанции. Сколько при этом расходуется SF6, никто точно не знает. А кроме того, Китай не входит в число стран, обязанных отчитываться по этому показателю».
Сегодня промышленность проводит испытания целого ряда альтернативных соединений, призванных заменить гексафторид серы. Результаты испытаний пока неизвестны, но проблему так или иначе надо решать. Ведь, по словам профессора Хартмута Грассля (Hartmut Graßl), много лет возглавлявшего гамбургский Институт метеорологии Общества Макса Планка, » с точки зрения парникового эффекта один килограмм SF6 эквивалентен 10 тоннам СО2″.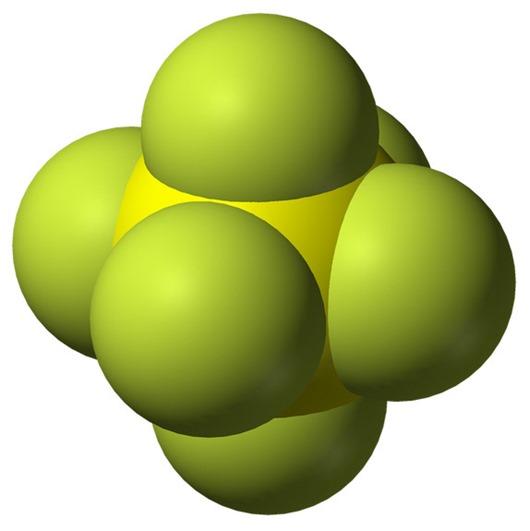
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
У чистой энергетики нашли «грязный секрет»
Западные эксперты предупреждают о том, что рост числа возобновляемых источников энергии (ВИЭ) провоцирует выбросы в атмосферу всё больших объёмов гексафторида серы. Это самый мощный парниковый газ из всех известных человечеству, который в 23 с половиной тысячи раз сильнее, чем CO₂. Значит ли это, что избежать глобального потепления не удастся даже в случае отказа от ископаемого топлива?
Уникальные свойства фторида серы или элегаза были открыты советскими учёными, которые искали надёжный изоляционный материал для высоковольтных распределительных устройств, трансформаторов и выключателей. Несмотря на довольно высокую стоимость, он очень быстро потеснил своего основного конкурента – трансформаторное масло — в связи с тем, что позволил снизить массу и габариты конструкций, необходимых для надёжной работы электростанций и подстанций. А ещё повысил их безопасность, исключив вероятность пожаров и взрывов.
© sib-el.ruВ восьмидесятых годах прошлого века SF₆ начали применять в качестве диэлектрика во всём мире. Тот факт, что в процессе эксплуатации он разлагается и неизбежно попадает в воздух, тогда никого не интересовал. Как ни странно, о его пагубном воздействии на атмосферу Земли мало кто задумывается и сегодня. Шестифтористая сера, например, используется для изоляции в ветряных турбинах. И, конечно же, в распределителях, принимающих энергию, которую вырабатывают ВИЭ. Причём, для успешной эксплуатации последних, таких распределителей в сети требуется больше, чем для традиционных цепочек энергоснабжения, а значит, эмиссия элегаза в мире постепенно увеличивается.
«Утечка малоизвестного газа в Великобритании и остальном Евросоюзе эквивалентна выбросу на дороги дополнительных 1,3 млн автомобилей. Уровни выбросов растут — это непреднамеренное следствие бума зеленой энергетики. В то же время каждая молекула гексафторида серы сохраняется в атмосфере Земли очень длительное время, нагревая нашу планету в течение тысячи лет», — бьёт тревогу эксперт BBC Мэтт МакГраф.
Он напоминает, что CO₂, о пагубном влиянии которого на глобальное потепление сегодня так много говорится, на самом деле очень слабый парниковый газ. Он гораздо менее эффективно улавливает тепло по сравнению с тем же метаном (CH₄) или оксидом азота (N₂O). Причина, по которой диоксид углерода оказывает наибольшее влияние на климат, заключается в том, что он, как и элегаз, очень долговечен, при этом его концентрация в атмосфере сейчас крайне велика — около 410 частей на миллион. А SF₆ — всего около 10 частей на триллион, то есть в 41 миллион раз меньше. Но это пока. А что будет дальше?
© Александр СитенькийМэтт МакГраф говорит, что сегодня во всех распределительных сетях британской энергосистемы задействовано около миллиона килограммов фторида серы. Эта цифра, согласно исследованию Кардиффского университета, ежегодно увеличивается на 30-40 тонн в год. Учитывая тот факт, что строительство новых ветрогенераторов и солнечных панелей на Туманном Альбионе идёт опережающими темпами, через десять лет она может вырасти на 75%.
© NOAA, IPCC«Учёные сравнивают перспективу воздействия различных парниковых газов на окружающую среду, используя нехитрую формулу. Мы говорим, что одна молекула элегаза будет иметь такой же согревающий эффект, как и 23 500 молекул CO₂. Это значит, что степень негативного влияния SF₆ на климат можно высчитать, умножив его текущую концентрацию в атмосфере на данный коэффициент (GWP — global warming potentials). Хотя этот подход является очень упрощенным, он всё же даёт возможность понять, что углекислый газ оказывает гораздо большее влияние на потепление. И будет оказывать большее влияние даже в том случае, если эмиссия фторида серы действительно возрастёт на 75%», — приводит портал The Conversation мнение группы учёных из Университета Восточной Англии, вступивших в заочную полемику с BBC.
Представители высшей школы Соединённого королевства уверены в том, что статья обозревателя этого медиахолдинга является некорректной, поскольку «сеет необоснованные сомнения относительно общих климатических преимуществ возобновляемых источников энергии». На самом же деле «климатические выгоды, вытекающие из увеличения доли ВИЭ в общем объёме генерации электроэнергии, очевидны». А вклад, который «гексафторид серы внесёт в загрязнение окружающей среды за 100-летний период, составит лишь 0,04% от общего ущерба, нанесённого выбросами всех парниковых газов». То есть будет ничтожным.
На самом же деле «климатические выгоды, вытекающие из увеличения доли ВИЭ в общем объёме генерации электроэнергии, очевидны». А вклад, который «гексафторид серы внесёт в загрязнение окружающей среды за 100-летний период, составит лишь 0,04% от общего ущерба, нанесённого выбросами всех парниковых газов». То есть будет ничтожным.
«Шестифтористая сера — очень мощный парниковый газ. Его эмиссия должна регулироваться и сокращаться, а правительства обязаны поощрять разработку альтернативных электрических изоляторов. Важно также продолжать мониторинг загрязнения атмосферы этим газом, чтобы гарантировать жизнеспособность стратегий по сокращению выбросов. Однако необходимо понимать, что вклад диоксида серы в процесс глобального потепления очень мал, поэтому гипертрофированные сообщения СМИ не должны подвергать сомнению необходимость декарбонизации энергосистем и предприятий во всём мире», — считают в Университете Восточной Англии.
Там уверены, что именно выбросы CO₂, растущие с каждым годом, представляют наибольшую опасность для дальнейшего существования человечества. Если их объёмы не станут значительно меньше, причём в краткосрочной перспективе, то климатические изменения достигнут точки невозврата и поставят крест на дальнейшем развитии цивилизации.
Парниковые газы — Что такое Парниковые газы?
Парниковые газы — газы с высокой прозрачностью в видимом диапазоне и с высоким поглощением в тепловом инфракрасном диапазоне.Подобно стеклу теплицы, газы в нашей атмосфере парниковые газы поддерживают жизнь на Земле, улавливая солнечное тепло.
Эти газы позволяют солнечным лучам согревать Землю, но предотвращают выход этого тепла из нашей атмосферы в космос.
Без естественных, улавливающих тепло газов — главным образом водяного пара, углекислого газа, метана, озона (O3) — Земля была бы слишком холодной (-18оC), чтобы поддерживать жизнь.
Опасность заключается в быстром увеличении количества углекислого газа и других парниковых газов, которые усиливают этот естественный парниковый эффект.

В течение 1000 — летий мировое снабжение углеродом было стабильным, поскольку естественные процессы удаляли столько углерода, сколько они выделяли.
Ныне баланс нарушен по многим причинам:
- сжигание ископаемого топлива,
- вырубка лесов,
- интенсивное сельское хозяйство.
Сегодня в атмосфере содержится на 42% больше CO2, чем в начале индустриальной эры.
Уровни метана (CH₄) и углекислого газа сейчас экстремально высокий за полмиллиона лет.
Киотский протокол охватывает 6 парниковых газов:
- углекислый газ,
- метан,
- закись азота (N2O),
- гидрофторуглероды,
- перфторуглероды,
- гексафторид серы (SF6).
Двуокись углерода является основной причиной изменения климата, особенно в результате сжигания ископаемого топлива.
Метан образуется естественным путем, когда растительность сжигается, переваривается или гниет без присутствия кислорода. Большое количество метана выбрасывается скотоводством, свалками, рисоводством, добычей нефти и природного газа.
Бурение на нефть и газ и гидроразрыв пласта (ГРП) являются основными источниками загрязнения метаном из-за утечек из поврежденного или неправильно установленного оборудования и преднамеренного выброса газа.
Закись азота, выделяемая химическими удобрениями и сжиганием ископаемого топлива, обладает потенциалом глобального потепления, в 310 раз превышающим потенциал углекислого газа.
Нарушая атмосферный баланс, который поддерживает климат, мы теперь наблюдаем экстремальные последствия по всему земному шару.
Климат меняется, и становится теплее.
Экстремальные погодные явления также становятся более распространенными.
Эти эффекты уже оказывают существенное влияние на экосистемы, экономику и сообщества.
Проблема в том, что человечеству кажется эта проблема чем-то далеким.
При нынешних скоростях роста выбросов температура может увеличиться на 2 °C, которые Межправительственная группа экспертов по изменению климата (IPCC) ООН определила в качестве верхнего предела, чтобы избежать опасных уровней, уже к 2036 г.
Но бизнес и прибыль — гораздо ближе.
Разговоры о декарбонизации экономики сразу прекращаются во время кризисов.
Добывающие страны неистово увеличивают добычу нефти и газа.
Во главе этого процесса идут власти США, которые не участвуют в Венском соглашении ОПЕК+ по сокращению добычи нефти.
Но даже Венское соглашение во главу угла ставит не декарбонизацию экономики, а ребалансировку мирового рынка нефти с целью удержания равновесной цены на нефть в диапазоне 60-70 долл США/баррель.
Экологи считают, что ценообразование на углеродные энергоносители является наиболее эффективным способом уменьшения углеродного загрязнения, которое меняет наш климат.
Чем больше кто-то загрязняет, тем больше он должен платить.
Цена на углерод делает загрязнение более дорогим, а решения, такие как экологически чистая энергия и электромобили, более доступными.
Но на практике рекомендации экологов не выполняются.
Гексафторид селена — свойства, получение и применение
Соединения фтора
Тетрафторметан — бинарное химическое соединение. Химическая формула — CF4. Другие названия — четырёхфтористый углерод, тетрафторид углерода. Коммерческие
Соединения фтора
Фторид нáтрия — неорганическое бинарное соединение с химической формулой NaF. Белое кристаллическое вещество. Фторид натрия Общие
Белое кристаллическое вещество. Фторид натрия Общие
Соединения фтора
Фторсульфонат рубидия — неорганическое соединение, соль рубидия и фторсульфоновой кислотыс формулой RbSO3F, белые кристаллы. Фторсульфонат
Соединения фтора
Фторохромат калия — неорганическое соединение, соль калия и фторохромовой кислоты с формулой KCrO3F, красные кристаллы,
Соли ртути
Хлорид ртути HgCl2 — бесцветные кристаллы ромбической системы. Хлорид ртути(II) Общие Систематическоенаименование Хлорид ртути(II) Традиционные
Бромиды
Бромид галлия(I) — неорганическое соединение, соль галлия и бромистоводородной кислоты с формулой GaBr, серо-зелёные кристаллы.
[Гексафторид серы]
Посмотрите наше видео на YouTube.
IUPAC Standards Online — это база данных, созданная на основе стандартов и рекомендаций IUPAC, взятых из журнала Pure and Applied Chemistry (PAC). Международный союз теоретической и прикладной химии (IUPAC) — это организация, отвечающая за установление стандартов в химии, которые являются обязательными на международном уровне для ученых в промышленности и академических кругах, патентных юристов, токсикологов, ученых-экологов, законодателей и т. Д.«Стандарты» — это определения терминов, стандартных значений, процедур, правил наименования соединений и материалов, названий и свойств элементов в периодической таблице и многое другое. База данных — единственный продукт, который обеспечивает быстрый и легкий поиск стандартов и рекомендаций ИЮПАК, которые до сих пор оставались несекретными в огромном архиве Pure and Applied Chemistry .
Охваченные темы:
- Аналитическая химия
- Биохимия
- Химическая безопасность
- Управление данными
- Образование
- Химия окружающей среды
- Неорганическая химия
- Материалы
- Медицинская химия
- Номенклатура и терминология
- Органическая химия
- Физическая химия
- Теоретическая и вычислительная химия
- Токсикология
IUPAC и De Gruyter
В дополнение к базе данных стандартов IUPAC, De Gruyter с гордостью сотрудничает с IUPAC в публикации отчета общества. ведущий ежемесячный журнал «Чистая и прикладная химия», а также ежеквартальный общественный журнал новостей Chemistry International и новый журнал открытого доступа Chemistry Teacher International.Ссылки на весь контент IUPAC, доступный на De Gruyter Online, можно найти на домашней странице IUPAC и De Gruyter, наряду со специальным контентом, таким как тематические виртуальные выпуски контента, взятого из разных журналов и томов.
Гексафторид серы — Электронные фторуглероды
Формула: SF 6 или SF6
Гексафторид серы (SF6) — это бесцветный, нетоксичный сжиженный газ без запаха. Поставляется в виде жидкости под давлением собственного пара.
Отправьте свои данные, и один из наших агентов свяжется с вами.
Примечание: для этого содержимого требуется JavaScript.Приложения
Гексафторид серы (SF6) используется для плазменного травления перед химическим осаждением из паровой фазы (CVD). Эти процессы включают травление оксида, травление нитридом и очистку пластины. Газообразный гексафторид серы, который сам по себе является инертным, диссоциирует в присутствии высокочастотного поля с образованием реактивных ионов фтора.Эти высокореактивные ионы отлично подходят для травления пленок вольфрама и силицидов вольфрама.
| 3 класс | 4 класс | Оценка 4.5 | 5 класс | |
|---|---|---|---|---|
| Чистота | 99,9% | 99,99% | 99,995% | 99,999% |
| Азот | <40 частей на миллион по объему | <20 частей на миллион по объему | <5 частей на миллион по объему | |
| Кислород | <10 частей на миллион по объему | <10 частей на миллион по объему | <2 частей на миллион по объему | |
| Воздух (N2 + O2) | <400 частей на миллион по объему | |||
| CF4 | <400 частей на миллион по объему | <15 частей на миллион по объему | <15 частей на миллион по объему | <5 частей на миллион по объему |
| Вода | <8 частей на миллион по объему | <8 частей на миллион по объему | <5 частей на миллион по объему | <2 частей на миллион по объему |
| Кислотность (HF) | <0. 3 ppm / w 3 ppm / w | <0,3 частей на миллион / масс | <0,1 частей на миллион / масс | <0,1 частей на миллион / масс |
** Уровень влажности гарантирован только при подготовке цилиндров электронными фторуглеродами.
Все концентрации даны на основе моль / моль, если не указано иное.
Продукт продается по общему количеству примесей. Отдельные примеси могут незначительно отличаться.
| Химические и физические свойства | |
| Молекулярный вес | 146.05 |
| Удельный объем | 2,65 куб. Футов / фунт |
| Давление при 70 град. | 298 фунтов на кв. Дюйм |
| Выпускной клапан | CGS 590 DISS 716 |
| Информация о доставке | |
| Имя DOT | Гексафторид серы |
| Класс опасности | 2,2 |
| ТОЧКА № | ООН 1080 |
| Этикетка DOT | Зеленый негорючий газ |
| № CAS | 2551-62-4 |
| Размер цилиндра | Масса заполнения (фунты) |
| 44L / Размер 200 | 115 |
| 16 л / размер 80 | 35 |
| 10 л / размер 60 | 22 |
| 7L / Размер 35 | 18 |
* Этот газ недоступен для покупки в Интернете.
WebElements Периодическая таблица элементов »Сера» гексафторид серы
- Формула: SF 6
- Формула системы Хилла: F 6 S 1
- Регистрационный номер CAS: [2551-62-4]
- Формула веса: 146.
 056
056 - Класс: фторид
- Цвет: бесцветный
- Внешний вид: газ
- Температура плавления: -50,5 ° C
- Температура кипения: -63,8 ° C
- Плотность: 6.4 кг дм -3
Ниже приведены некоторые синонимы гексафторида серы :
- гексафторид серы
- фторид серы (VI)
- фторид серы
- гексафторид серы
- фторид серы (VI)
- фторид серы
Степень окисления серы в гексафториде серы составляет 6 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия серы: 6 координата: октаэдрическая
- Прототипная структура:
Элементный анализ
В таблице показано процентное содержание элементов для SF 6 (гексафторид серы).
| Элемент | % |
|---|---|
| Ф | 78.05 |
| S | 21,95 |
Изотопная диаграмма для SF
6На приведенной ниже диаграмме показана расчетная изотопная структура для формулы SF 6 с наиболее интенсивным ионом, установленным на 100%.
Список литературы
Данные на этих страницах составлены и адаптированы из первичной литературы и нескольких других источников, включая следующие.
- R.T. Сандерсон в Chemical Periodicity , Рейнхольд, Нью-Йорк, США, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2nd edition, Butterworth, UK, 1997.
- F.A. Cotton, G. Wilkinson, C.
 A. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
A. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999. - А.Ф. Тротман-Дикенсон, (ред.) В Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- R.W.G. Вайкофф, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R. West in Основы химии твердого тела Химия , John Wiley & Sons, 1999.
- A.F. Wells в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- J.D.H. Донней (ред.) В Таблицах для определения кристаллических данных , монография ACA номер 5, Американская кристаллографическая ассоциация, США, 1963.
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996 г.
- J.W. Меллор в Комплексный трактат по неорганической и теоретической химии , тома 1–16, Longmans, Лондон, Великобритания, 1922–1937.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1-3, Chapman & Hall, Лондон, Великобритания, 1992.
Изучите периодические свойства по этим ссылкам
Факты о гексафториде серы для детей
Гексафторид серы , также известный как фторид серы (VI) , представляет собой химическое соединение.Его химическая формула — SF 6 . Он содержит серу в степени окисления +6. Он также содержит ионы фтора.
BBC News сообщает: «Это самый мощный парниковый газ, известный человечеству, и в последние годы резко возросли выбросы. Гексафторид серы, или SF6, широко используется в электротехнической промышленности для предотвращения коротких замыканий и аварий. Утечки малоизвестных бензин в Великобритании и остальных странах ЕС в 2017 году был эквивалентен запуску дополнительных 1,3 миллиона автомобилей на дорогах ».
Недвижимость
Гексафторид серы — это бесцветный газ без запаха. Это очень тяжело для газа (примерно в 5 раз тяжелее воздуха). Он не реагирует, и трудно найти что-либо, что с ним реагировало бы. Это сильный парниковый газ. Это заставило людей наложить некоторые ограничения на его использование.
Это очень тяжело для газа (примерно в 5 раз тяжелее воздуха). Он не реагирует, и трудно найти что-либо, что с ним реагировало бы. Это сильный парниковый газ. Это заставило людей наложить некоторые ограничения на его использование.
Препарат
Его получают в результате реакции серы с фтором. Эта комбинация также образует токсичный декафторид дисеры, который необходимо удалить.
использует
Применяется в электронике и различных электрических устройствах.Его можно использовать в организме, поскольку он не токсичен. Его можно использовать в качестве испытательного газа, например, чтобы посмотреть, где течет газ в системе обогревателя. Обнаруживается легко. Используется в некоторых торпедах. Литий — одно из немногих веществ, которое вступает в реакцию с гексафторидом серы. Гексафторид серы распыляется на литий. Это делает литий очень горячим. Он создает пар из воды и стреляет в торпеду. Его можно вдохнуть, чтобы сделать голос глубже. Это противоположно вдыханию газообразного гелия.
Безопасность
Гексафторид серы не токсичен.Однако он может заполнять закрытые пространства. Человек может задохнуться в закрытом помещении, если гексафторид серы вытолкнул кислород из помещения.
Парниковый газ
Таймсерии гексафторида серы Мауна-Лоа. По данным Межправительственной группы экспертов по изменению климата, SF 6 является наиболее сильным парниковым газом, который она оценила, с потенциалом глобального потепления (GWP) в 22 800 раз больше, чем CO 2 по сравнению с 100-летним периодом. . Измерения SF 6 показывают, что его глобальный средний коэффициент смешивания увеличился примерно на 0.От 2 п.п. в год до более 7 п.п. Гексафторид серы также очень долгоживущий. Он инертен в тропосфере и стратосфере. Расчетная продолжительность жизни в атмосфере составляет 800–3200 лет. SF 6 очень стабилен. (Для стран, сообщающих о своих выбросах в РКИК ООН, на третьей Конференции Сторон был предложен ПГП в размере 23 900 для SF 6 : ПГП используется в Киотском протоколе). Средние глобальные концентрации SF 6 увеличивались примерно на семь процентов в год в течение 1980-х и 1990-х годов, в основном в результате его использования в промышленности по производству магния, а также производителями электрооборудования и электроники.Принимая во внимание низкие выбросы SF 6 по сравнению с двуокисью углерода, его общий вклад в глобальное потепление оценивается менее чем на 0,2 процента.
Средние глобальные концентрации SF 6 увеличивались примерно на семь процентов в год в течение 1980-х и 1990-х годов, в основном в результате его использования в промышленности по производству магния, а также производителями электрооборудования и электроники.Принимая во внимание низкие выбросы SF 6 по сравнению с двуокисью углерода, его общий вклад в глобальное потепление оценивается менее чем на 0,2 процента.
В Европе SF 6 подпадает под действие директивы по фторсодержащим газам, которая запрещает или контролирует его использование несколькими способами. С 1 января 2006 года SF 6 запрещен в качестве индикаторного газа для всех применений, кроме высоковольтных распределительных устройств.
Связанные страницы
Соль
Образы для детей
Атмосферная концентрация SF6 vs.аналогичные техногенные газы (правый график). Обратите внимание на масштаб журнала.
Молекулярная масса гексафторида серы
Молярная масса of SF6 = 146,0554192 г / моль
Перевести граммы гексафторида серы в моль или моль гексафторида серы в граммы
Расчет молекулярной массы:
32.065 + 18.9984032 * 6
| Элемент | Символ | Атомная масса | Количество атомов | Массовый процент |
| Фтор | F | 18.9984032 | 6 | 78,046% |
| Сера | S | 32.065 | 1 | 21,954% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий.Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Гексафторид серы — мой любимый элемент: сера
* Гексафторид серы *
Свойства: Гексафторид серы — неорганический, бесцветный, негорючий парниковый газ. Этот газ плохо растворяется в воде, но растворяется в неполярных органических растворителях. Он имеет более высокую плотность, чем воздух, 6,12 г / л, поэтому является чрезвычайно тяжелым газом.
Этот газ плохо растворяется в воде, но растворяется в неполярных органических растворителях. Он имеет более высокую плотность, чем воздух, 6,12 г / л, поэтому является чрезвычайно тяжелым газом.
Молярная масса: 146,06 г / моль
Точка плавления: -50,8
Точка кипения: -64 ° C
Прочность связи: 6/6 = 1
Применение: SF6 часто используется в медицинских целях, при ремонте при отслоении сетчатки он обеспечивает заглушку для отверстия сетчатки.Это также контрастный агент для ультразвуковой визуализации, когда он вводится в периферическую вену и улучшает видимость в кровеносных сосудах для ультразвуковых исследований. Другая важная часть этого соединения находится в электротехнической промышленности, где используется в качестве выключателя. Его можно использовать как изолятор под давлением, поскольку он имеет более высокую электрическую прочность, чем воздух. Это позволяет значительно уменьшить габариты электрооборудования. Наконец, гексафторид серы также используется в качестве индикаторного соединения.Его часто используют в экспериментах для проверки скорости инфильтрации и эффективности вентиляции. Например, в одном исследовании это соединение использовалось в качестве нетоксичного тестового газа и выбрасывалось в окружающую среду, и отслеживалось, как он перемещался по окружающей среде. Целью этого исследования было выяснить, как токсичный газ может распространяться по станциям метро в Лондоне во время террористических атак.
Тип связи: Это соединение состоит из 6 атомов фтора, прикрепленных к центральному атому серы.В этой связи сера не достигает правила октетов, как показано ниже в структуре Льюиса, однако фтор достигает из-за своей высокой электроотрицательности. Структура имеет атом серы в середине с 6 атомами фтора, окружающими эту структуру. Каждый атом фтора имеет 3 неподеленные пары для выполнения правила октетов. Кроме того, эта связь является полярной ковалентной. Это разделение электронов между двумя неметаллами, в котором фтор имеет более высокую электроотрицательность, и поэтому электроны находятся ближе к ядрам атомов фтора.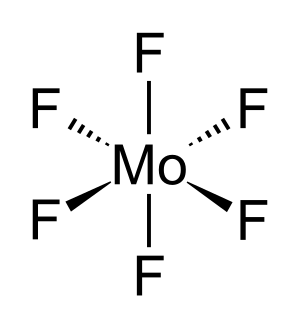
Трехмерная структура: Эта структура имеет серу в качестве центрального атома и 6 атомов фтора, окружающих ее одинарными связями. Sulphur имеет 6 общих пар и 0 неразделенных пар. Это классифицирует соединение как октаэдрическое с углами между атомами 90 градусов. Опять же, Sulphur не соответствует правилу октетов, поскольку фтор имеет более высокую электроотрицательность.
Межмолекулярные силы: гексафторид серы представляет собой неполярную структуру из-за симметрии и связей. Следовательно, он будет испытывать лондонские дисперсионные силы, которые существуют среди неполярных молекул.Эти атомы развивают временную дипольную структуру заряда, когда их атомы движутся вокруг ядра и могут индуцировать эти диполи в соседних атомах. Эти силы слабые и не очень значительны, кроме как в больших атомах и молекулах, подобных этой. Гексафторид серы представляет собой большую молекулу, и из-за количества увеличенных электронов дипольные моменты немного увеличиваются, потому что больше электронов, вызывающих эти мгновенные моменты. Однако, поскольку связь относительно слабая по сравнению с другими силами, точки плавления и кипения этого соединения низкие, поскольку связи легко разрушаются.
Lewis Structure
Гексафторид серы — Sciencemadness Wiki
Гексафторид серы , иногда сокращенно SF6 , представляет собой неорганическое, бесцветное, негорючее тяжелое газообразное химическое соединение без запаха без запаха с интересными свойствами. Его химическая формула: SF 6 .
Недвижимость
Химическая промышленность
Гексафторид серы почти химически инертен. Он не горит на воздухе и не вступает в реакцию с другими газами.SF6 не будет реагировать с расплавленным натрием, но будет реагировать с расплавленным металлическим литием. При подаче электрического тока SF6 непропорционально декафториду серы и газообразному фтору:
- 2 SF 6 → S 2 F 10 + F 2
Физический
Гексафторид серы — инертный газ без цвета и запаха. Это хороший электроизолятор. Его плотность 6,12 г / л при стандартных условиях почти в 5 раз больше плотности воздуха (1,225 г / л).
Это хороший электроизолятор. Его плотность 6,12 г / л при стандартных условиях почти в 5 раз больше плотности воздуха (1,225 г / л).
Наличие
Гексафторид серы можно приобрести у нескольких компаний, таких как Praxair, Concordeair, Airgas, ElectronicFluorocarbons в баллонах со сжатым газом. В России он продается под названием Elegas (Элегаз), от слов «электрическая изоляция» и «газ».
Препарат
Гексафторид серы можно получить реакцией элементарной серы с газообразным фтором, а затем промывкой полученного газа в растворе щелочи для удаления тетрафторида серы.Однако, поскольку для этого процесса требуется очень опасный элементарный фтор, безопаснее просто покупать газ у продавцов.
Проектов
- Инертный газ для литья чувствительных к воздуху металлов (например, магния)
- Альтернативный инертный газ для хранения чувствительных к воздуху химических соединений
- Газообразная диэлектрическая среда
- Волшебная плавающая [фольга] лодка
- Баритонный голос
Обработка
Безопасность
Гексафторид серы, хотя и не является благородным газом, имеет аналогичные свойства, например нетоксичность и инертность.Однако он может вытеснять кислород в легких и может вызвать асфиксию при вдыхании слишком большого количества вещества. SF6 будет реагировать с расплавленным литием, но не с другими обычными металлами, что делает его безопасным для использования в качестве инертного газа.
Хранилище
Баллоны с элегазомследует хранить в холодных местах вдали от источников тепла. Лучше избегать хранения его в подвале, так как в случае утечки он может вытеснить весь воздух из комнаты, создав немного большую опасность удушья, чем CO 2 , поскольку его нельзя удалить с помощью скрубберов.
Утилизация
Гексафторид серы — один из самых мощных парниковых газов, его потенциал глобального потепления в 23 900 раз выше, чем у CO 2 .
