Анилиновая кислота – Олеиновая кислота — свойства и применение
Олеиновая кислота — свойства и применение
Олеиновая кислота относится к категории непредельных кислот и является (из всех непредельных кислот) наиболее распространенной в природе, особенно в растительных маслах (оливковом, пальмовом, подсолнечном) и жирах животного происхождения. Внешне представляет собой маслянистую жидкость без цвета и запаха, хотя кислота, используемая в промышленных целях (производстве резины, металлообработке) может иметь желтоватый оттенок. Своё название «олеиновая» данный тип кислот получил благодаря оливковому маслу, где его содержится более 80%. Тем не менее, она содержится и во многих других продуктах, в частности в арахисовом масле — порядка 65%, в подсолнечном и говяжьем жире – около 40 %.
Свойства и сфера применения олеиновой кислоты
Данный тип кислот безвреден при попадании на кожу человека, не растворяется в воде. Для удаления можно использовать спирт, ацетон, хлороформ, эфир. При эксплуатации необходимо учесть, что при взаимодействии с кислородом и ультрафиолетом вещество окисляется и темнеет. Поэтому олеиновую кислоту следует хранить в непрозрачной, плотно закрытой таре.
Сфера применения олеиновой кислоты обширна и охватывает многие направления человеческой деятельности – от медицины и косметологии до металлообработки и производства резинотехнической продукции. В частности, олеиновая кислота применяется в пищевой промышленности при производстве ароматизаторов, в целлюлозно-бумажной – в качестве пластификатора целлюлозы. Используется она и при производстве лак, олиф, эмульгаторов. Широкое применение данный тип непредельных кислот получил в металлообработке, особенно в качестве смазочно-охлаждающей жидкости при металлорежущих операциях.
Олеиновая кислота в металлорежущем инструменте
Широкое применение олеиновая кислота получила при обработке твердых высоколегированных сплавов, в т. ч. и нержавеющих сталей. Смазывающие свойства материала значительно упрощают процесс сверления биметаллическими и др. типами коронок нержавеющих сталей. Олеиновая кислота практически незаменима при токарных операциях с твердыми сплавами, при сверлении и нарезании резьб.
В составе специальных смесей олеиновая кислота используется и для доводки поверхностей деталей со съёмом слоя металла толщиной до 22 микрон. Используется она и для доводки инструмента и его рабочих частей, а также формирования точных уплотнительных поверхностей.
Несмотря на широкое внедрение синтетических материалов, олеиновая кислота продолжает оставаться наиболее оптимальным видом СОЖ для обработки металлических изделий из твердых сплавов, широко применяется в современной металлообработке.
mekkain.ru
Свойства и применение анилина
Анилин — органическое вещество. Впервые его получили в 1826 году. Другие названия – фениламин, аминобензол. Наименование «анилин» произошло от названия растения «индигофера анил», в котором содержится индиго. Раньше фениламин создавался с участием этого вещества. Рассмотрим свойства и применение анилина.

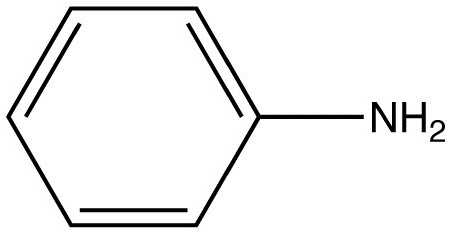
Вещество относится к простейшим ароматическим аминам. Его формула C6H5NH2.
Физические свойства анилина
Ядовитое вещество, пары которого токсичны. Представляет собой маслянистую жидкость, не имеющую цвета. Запах слабый, характерный именно для этого вещества. При его возгорании пламя яркое, коптящее.
Частично растворим в воде (при температуре кипения растворимость 6,4 %). Минерализованная вода понижает его растворимость, за исключением содержания бромидов лития и цезия, а также йодида цезия. Последний, наоборот, повышает растворимость анилина.
При хранении вещество темнеет, особенно быстро это происходит при воздействии воздуха и света. При этом он делается более вязким. Иначе данный процесс называют «аутооксидацией». Окисление может быть замедленно при помощи добавления антиоксидантов – щавелевой кислоты, гидро- и тиосульфата натрия.
Ниже приведены характеристики анилина при нормальном атмосферном давлении:
- температура кипения — 184,4 °С;
- температура плавления/замерзания – минус 5,89 °С;
- плотность при температуре 20 °С — 1,02 г/см куб.;
- температура самовоспламенения на воздухе — 562 °C;
- температура вспышки на воздухе – 79 °C.
Основные области применения анилина
В России вещество в основном применяют для синтеза красителей и лекарственных средств, в текстильной и фармацевтической промышленности. С помощью анилина получают препараты группы сульфамидов, обладающие антибактериальным действием, а также синтезируют заменители сахара.
Существуют и другие области применения аниолина. В химии его используют для получения гидрохинона – вещества, использующегося в косметике, в основном в составе отбеливающих кожу средств. Также вещество применяется в создании взрывчатых веществ, клеев, герметиков.
При помощи анилина замедляется коррозия металлов: его фосфаты добавляют к растворам сильных электролитов, в результате чего ингибируется коррозия углеродистой стали.
Применяют анилин и для повышения антидетонационности топлива (автомобильного, ракетного, авиационного). Октановое число бензина при однопроцентном содержании анилина повышается на 3 единицы и более. Но в чистом виде вещество стараются не использовать, так как при длительном хранении понижается качество бензина с анилином, а также токсичность его газов. Чаще используются производные вещества. В ряде западных государств существуют ограничения на применение анилина в составе топлива.
В мире большая часть получаемого анилина используется в производстве полиуретанов, а также синтетических каучуков, красок, средств от сорняков.
Анилиновые красители
Самой главной сферой применения анилина было и остается производство красителей. Они изготовляются при помощи окисления анилина и его солей.

Первоначально анилиновые краски выпускались только в форме порошка. В СССР им находили применение в быту, реставрируя и переделывая вещи посредством их окраски. Но покрашенные вещи быстро блёкли при попадании солнечного света, краска вымывалась в процессе стирки. В настоящее время анилиновые красители производятся и в форме растворов, причем некоторые производители выпускают концентрированные растворы, которые в отличие от порошков не требуют особой подготовки ткани. Но, несмотря на ощутимый прогресс и улучшение красителей, ткани, покрашенные ими, по-прежнему быстро выгорают на солнце.
Токсичность анилина
Анилин — токсичное вещество. Может угнетать нервную систему, при попадании в кровь вызывает кислородное голодание тканей. Попасть в организм может в виде паров, а также проникнуть через кожу и слизистые оболочки.

Сейчас отравления анилином бывают редко. Опасность это вещество представляет в основном для тех, кто работает с ним. Во избежание попадания токсина в организм нужно соблюдать установленные меры безопасности. При окрашивании дома вещей анилиновыми красителями, в особенности порошковыми, нужно беречь их от детей, проветривать помещение, в котором производится окраска, не глотать вещество, при попадании на части тела немедленно смывать его водой и производить окрашивание в перчатках. Если анилин был случайно проглочен, нужно незамедлительно обращаться к врачу.
fb.ru
анилин | PPDB
Каталог пестицидов — PPDB
| aniline ** phenylamine ** cyanol ** benzamine ** benzidam ** На других языках |
Поведение в окружающей среде — Экотоксичность — Здоровье человека — Токсиколого-гигиеническая характеристика
Описание: Продукт преобразования пестицида
Год официальной регистрации: Не определяется
Выпуск пестицидов на рынок (директива 91/414/ЕЭС), статус:
| Статус | Не определяется |
| Досье докладчика / содокладчика | Не определяется |
| Дата включения истекает | Не определяется |
Разрешен к применению (V) или известен (#) в следующих Европейских странах:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные сведения:
| Тип пестицида | Метаболит |
| Тип метаболита | почва |
| Группа по химическому строению | Aromatic amine |
| Характер действия | Не применимый |
| Регистрационный номер CAS | 62-53-3 |
| Шифр КФ (Код Фермента) | — |
| Шифр Международного совместного аналитического совета по пестицидам (CIPAC) | — |
| Химический код Агентства по охране окружающей среды США (US EPA) | Не определяется |
| Химическая формула | C6H7NO |
| SMILES | NC1=CC=CC=C1 |
| Международный химический идентификатор (InChI) | — |
| Структурная формула | |
| Молекулярная масса (г/моль) | 93.1 |
| Chemical Перевод | aminobenzene |
| Другая информация | — |
| Устойчивость к гербициду по HRAC | Не определяется |
| Устойчивость к инсектициду по IRAC | Не определяется |
| Устойчивость к фунгициду по FRAC | Не определяется |
| Физическое состояние | Бесцветная жидкость |
Может быть продуктом:
| propham | почва | — | ||
Выпуск:
| Показатель | Значение | |||
| Производители пестицида |
| |||
| Коммерческие названия препаратов, содержащих д.в. | — | |||
| С этим веществом связаны: | — | |||
| Оценка риска от пестицида для местной экологии (Англия) | Не определяется | |||
| Препаративная форма и особенности применения | — | |||
| Растворимость в воде при 20oC (мг/л) | 36000 | V3 — @ 25 DegC | Высокий | |
| Растворимость в органических растворителях при 20 | — | — | — | |
| Температура плавления (oC) | -6.3 | Q3 | — | |
| Температура кипения (oC) | — | — | — | |
| Температура разложения (oC) | — | — | — | |
| Температура вспышки (oC) | 70 | P3 — (closed cup) | — | |
| Коэффициент распределения в системе октанол/вода при pH 7, 20oC | P: | 7.94 X 1000 | Рассчитывается | — |
| Log P: | 0.9 | V3 | Низкий | |
| Удельная плотность (г/мл) / Удельный вес | 1.02 | Q2 | — | |
| Константа диссоциации (pKa) при 25oC | 4.6 | V3 | — | |
| Примечание: Слабая кислота | ||||
| Давление паров при 25oC (МПа) | — | — | — | |
| Константа закона Генри при 25oC (Па*м3/моль) | — | — | — | |
| Константа закона Генри при 20oC (безразмерная) | — | — | — | |
| Период распада в почве (дни) | ДТ50 (типичный) | 2 | Q2 | Неустойчивый |
| ДТ50 (лабораторный при 20oC): | — | — | — | |
| ДТ50 (полевой): | — | — | — | |
| ДТ90 (лабораторный при 20oC): | — | — | — | |
| ДТ90 (полевой): | — | — | — | |
| Примечание: | ||||
| Водный фотолиз ДТ50 (дни) при pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водный гидролиз ДТ50 (дни) при 20oC и pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водное осаждение ДТ50 (дни) | — | — | — | |
| Только водная фаза ДТ50 (дни) | — | — | — | |
| Индекс потенциального вымывания GUS | 0.70 | Рассчитывается | Низкая выщелачиваемость | |
| Индекс роста концентрации в грунтовых водах SCI (мкг/л) при дозе внесения 1 кг/га (л/га) | Значение: | 1.62 X 10-03 | Рассчитывается | — |
| Примечание: | — | |||
| Potential for particle bound transport index | — | Рассчитывается | Низкий | |
| Koc — коэффициент распределения органического углерода (мл/г) | 47 | Q2 | Mobile | |
| pH устойчивость: | ||||
| Примечание: | ||||
| Изотерма адсорбции Фрейндлиха | Kf: | — | — | — |
| 1/n: | — | — | ||
| Примечание: | — | |||
| Максимальное УФ-поглощение (л/(моль*см)) | — | — | — | |
| Коэффициент биоконцентрации | BCF: | — | — | — |
| CT50 (дни): | — | — | ||
| — | Рассчитывается | Низкий | ||
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | 250 | V3 Крыса | Умеренно | |
| Млекопитающие — Короткопериодный пищевой NOEL | (мг/кг): | — | — | — |
| (ppm пищи): | — | — | ||
| Птицы — Острая ЛД50 (мг/кг) | 750 | V3 Phasianidae | Умеренно | |
| Птицы — Острая токсичность (СК50 / ЛД50) | — | — | — | |
| Рыбы — Острая 96 часовая СК50 (мг/л) | 0.041 | F4 Радужная форель | Высокий | |
| Рыбы — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные беспозвоночные — Острая 48 часовая ЭК50 (мг/л) | 0.15 | F4 Дафния магна (Дафния большая, Блоха водяная большая) | Умеренно | |
| Водные беспозвоночные — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные ракообразные — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Острая 96 часовая СК50 (мг/л) | 175 | F4 Комар-хирономус | Низкий | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, static, Вода (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, Осадочная порода (мг/кг) | — | — | — | |
| Водные растения — Острая 7 дневная ЭК50, биомасса (мг/л) | — | — | — | |
| Водоросли — Острая 72 часовая ЭК50, рост (мг/л) | 19 | F4 Зеленая морская водоросль | Низкий | |
| Водоросли — Хроническая 96 часовая NOEC, рост (мг/л) | — | — | — | |
| Пчелы — Острая 48 часовая ЛД50 (мкг/особь) | — | — | — | |
| Почвенные черви — Острая 14-дневная СК50 (мг/кг) | — | — | — | |
| Почвенные черви — Хроническая 14-дневная максимально недействующая концентрация вещества, размножение (мг/кг) | — | — | — | |
| Другие почвенные макро-организмы, например Ногохвостки | LR50 / EC50 / NOEC / Действие (%) | — | — | — |
| Другие Членистоногие (1) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Другие Членистоногие (2) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Почвенные микроорганизмы | — | — | — | |
| Имеющиеся данные по мезомиру (мезокосму) | NOEAEC мг/л: | — | — | — |
| NOEAEC мг/л: | — | — | — | |
Основные показатели:
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | 250 | V3 Крыса | Умеренно | |
| Млекопитающие — Кожная ЛД50 (мг/кг массы тела) | 254 | P3 Cat | — | |
| Млекопитающие — Ингаляционная СК50 (мг/л) | 0.25 | P3 Крыса, 4hr | — | |
| ДСД — допустимая суточная доза (мг/кг массы тела в день) | — | — | — | |
| ARfD — среднесуточная норма потребления (мг/кг массы тела в день) | — | — | — | |
| AOEL — допустимый уровень системного воздействия на оператора | — | — | — | |
| Поглощение кожей (%) | — | — | — | |
| Директива по Опасным Веществам 76/464/ЕС | — | — | — | |
| Виды ограничений | — | — | — | |
| по категории | Общие: | — | ||
| Профессиональные: | — | |||
| Примеры Европейских МДУ (мг/кг) | Значение: | — | ||
| Примечание: | ||||
| ПДК в питьевой воде (мкг/л) | — | — | — | |
Токсиколого-гигиеническая характеристика:
V : Да, известно что вызывает
X : Нет, известно что не вызывает
? : Возможно, точно не определено
— : Нет данных
Законодательство:
| Основное | [Огнеопасен], [Вызывает коррозию], [IMDG Transport Code is usually 6.1] | ||||||
| Классификация рисков Европейской Комиссии | [ category 3: R40], [ic category 3: R68], [T- Токсичность: R23/24/25], [Xn — Вредность: R41, R48], [Xi — Раздражение:, R43], [N — Опасность для окружающей среды: R50] | ||||||
| Классификация безопасности Европейской Комиссии | S1/2, S26, S45, S46, S63, S27, S36/37/39, S60, S61 | ||||||
| Классификация ВОЗ | NL | — | Не описан | ||||
| Классификация Агентства по охране окружающей среды США (US EPA) | Не определяется | — | — | ||||
| UN Номер | 1547 | ||||||
| Упаковка и утилизация | [Обычно упаковывают в тару группы II (средняя опасность)] | ||||||
| Английский | aniline |
| Французский | — |
| Немецкий | — |
| Датский | — |
| Итальянский | — |
| Испанский | — |
| Греческий | — |
| Словенский | anilin |
| Польский | anilina |
| Шведский | — |
| Венгерский | — |
| Голландский | — |
Последнее обновление сайта: Friday 18 February 2011
rupest.ru
Анилин — это… Что такое Анилин?
Анили́н (фениламин) — органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
История
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин».
В 1834 Ф. Pyнгe обнаружил анилин в каменно-угольной смоле и назвал «кианолом».
В 1841 Ю. Ф. Фришце получил анилин нагреванием индиго с раствором KOH и назвал его «анилином».
В 1842 анилин был получен Н. Н. Зининым восстановлением нитробензола действием (NH4)2S и назван им «бензидамом».
В 1843 А. В. Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Получение
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 — 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов
Впервые восстановление нитробензола было произведено с помощью железа:
Другим способом получение анилина является восстановление нитросоединений — Реакция Зинина:
Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Окисление
В отличие от аминов алифатического ряда, ароматические амины легко окисляются. Примером может служить реакция хромовой смеси с анилином, в результате образуется краситель «черный анилин».
Реакции электрофильного замещения
Аминогруппа являясь заместителем первого рода оказывает сильное активирующее влияние на бензольное ядро, что при нитровании может произойти окисление молекулы анилина, для предотвращения окисления аминогруппу перед нитрованием «защищают» ацилированием
Реакции на азот
Другие реакции
Гидрирование анилина в присутствии никелевого катализатора дает циклогексиламин.
Производство и применение
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина.
По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина).[1]
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе.
Токсичные свойства
Анилин оказывает негативное воздействие на центральную нервную систему. Вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления крайне редки.
При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
При отравлении анилином необходимо прежде всего удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Так же вдыхание кислорода с карбогеном. Также применяют введение антидотов (метиленовая синь), сердечно-сосудистые средства. Пострадавшему надо обеспечить покой.
Предельно допустимая концентрация анилина в воздухе рабочей зоны 3 мг/м3. В водоёмах (при их промышленном загрязнении) 0,1 мг/л (100 мг/м3).[2]
См. также
Примечания
Литература
Артеменко А.И. — Органическая химия — 1987.
Ссылки
dic.academic.ru
Анилин
Анилин
Анилин (фениламин) С6H5NH2 — важнейший из ароматических аминов.
Формула
Электронное строение
Неподеленная пара электронов атома азота участвует в сопряжении с π-системой бензольного ядра (р,π-сопряжение). Поэтому ее способность к образованию донорно-акцепторной связи ослаблена. В связи с этим основные свойства анилина выражены в значительно меньшей степени, чем у алифатических аминов.
Являясь заместителем 1 рода, аминогруппа повышает электронную плотность в орто- и пара-положениях бензольного ядра (аналогия с фенолом).
Физические свойства
Анилин — бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, тяжелее воды, ядовит.
Химические свойства
I. Реакции с участием аминогруппы
Взаимодействие с кислотами (образование солей)
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Реакции с участием бензольного ядра
1. Галогенирование
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
Способы получения
Анилин получают из нитробензола восстановлением нитрогруппы -NO2 в аминогруппу -NH2. Эту реакцию открыл русский химик Н. Н. Зинин (реакция Зинина). Восстановление нитробензола он производил сульфидом аммония:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
Восстановление можно производить и в кислой среде атомарным водородом, который образуется при взаимодействии металлов с кислотами:
C6H5NO2 + 6Н → C6H5NH2 + 2H2O,
а также газообразным Н2 при высоком давлении в присутствии катализатора:
C6H5NO2 + 3Н2 → C6H5NH2 + 2H2O
examchemistry.com
Анилин — ЭНЭ
Анилин
(фениламин, бензидам, амидобензол) C6H5NH2 представляет органическое основание, играющее чрезвычайно важную роль в новейшей химии и хим. технологии как с научной, так и с промышленной стороны, так как вещество это является исходным материалом при искусственном получении анилиновых красок. Унфердорбен, химик в Даме (Саксония), нашел в 1826 г. между продуктами сухой перегонки. индиго маслообразное вещество, названное им кристаллином. Несколько лет спустя Рунге в Берлине открыл в каменноугольном дегте соединение, дающее с хлорной известью фиолетовое окрашивание. Основываясь на этом последнем свойстве, он дал ему название цианола (голубого масла). Позднее академик Фрицше в Петербурге изучал продукты, получающиеся при действии едкого кали на индиго, и нашел при этом маслообразное вещество с основными свойствами, которое назвал анилином от португальского названия индиго — «Anil». Наконец, в 1842 г. знаменитому русскому химику Н. Н. Зинину удалось из бензола (бензина), заключающегося в каменноугольном дегте, получить, переходя через восстановление нитробензола, маслообразное тело щелочного характера, названное им бензидамом. В 1843 г. А. Гофман показал, что четыре тела, кристаллин, цианол, анилин и бензидам, тождественны между собою, но право гражданства утвердилось только за названием «анилин», исходной же реакцией его получения и доныне остается классическое открытие праотца русских химиков, Зинина. После того как трудами Перкина, Гофмана, Вергена и др. в 1856-59 гг. были выработаны условия и способы фабрикации анилиновых красок, мало-помалу явились заводские способы получения А., причем производство его скоро достигло таких размеров, что в 1879 г. ежедневная добыча в Германии равнялась 9000 килог., во Франции — от 5 до 6000 килог. и в Англии — 2500 килог. При получении анилина поступают следующим образом: бензол (см. это сл.), жидкий углеводород, получающийся при перегонке каменноугольного дегтя, переводится обработкой дымящейся азотной кислотой в нитробензол, известный в парфюмерии под именем мирабановой эссенции, или мирабанового масла. Полученный таким образом нитробензол переводят в А. по способу французского химика Бешана, обработкой железными стружками и уксусной кислотой и последующей перегонкой с известью. В чистом виде А. представляет прозрачную, бесцветную, маслообразную жидкость с характерным слабоароматическим запахом и жгучим вкусом; он немного тяжелее воды (уд. вес при 0° — 1,0361), кипит при 182°, растворим в воде, а со спиртом, эфиром и т. д. смешивается во всех пропорциях. А. обладает хотя не весьма сильными, но все-таки ядовитыми свойствами. Служащий для производства красок анилин не представляет чистого соединения, а смесь его с другим основанием — толуидином С6H4(CH3)NH2. А. и его производные (метил-, этил-, фениланилины и др.) дают при действии некоторых химических агентов красящие вещества, назыв. анилиновыми красками (см. Краски). А. по своим превращениям является близким аналогом аминов; следуя общей номенклатуре, это — фениламин C6H5NH2. Но в силу содержания бензольного остатка А. вместе со своими гомологами и аналогами (толуидины, ксилидины и т. п.) обладает и многими характерными особенностями, из коих главное — это менее резко выраженные основные свойства аммиачного типа. Соли его с органическими кислотами непрочны, но разложение под влиянием температуры совершается главным образом не на кислоту и свободное основание, а на воду и анилиды; напр. уксуснокислая соль анилина C6H5NH2—C2H4O2 легко распадается на H2O и ацетанилид C6H5NH(C2H3O).
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.
Анилин, амидобензол, органич. основание, бесцветная маслянистая жидкость с характерным слабо ароматическим запахом, кипящая при 182°, застывающая при — 6°, мало растворимая в воде, уд. в. 1,024. Получается технически восстановлением нитробензола с помощью железных опилок и соляной кислоты; образует с кислотами твердые соли, например солянокислый анилин — «анилиновая соль», широко применяемая при крашении бумажных тканей. Анилин имеет чрезвычайно важное значение в химической технологии, так как служит исходным материалом для получения многочисленных анилиновых красок; главнейшее применение чистого анилина — при получении фуксиновой сини, метиланилина, дифениламина, при печатании для образования анилиновой черни, для крашения хлопчатой бумаги в черный цвет; Анилин прибавляется к нитроглицериновым порохам для повышения их стойкости; для получения анилиновых красок употребляется смесь анилина и толуидина (анилиновое масло). Анилиновые краски прочны и не ядовиты, в то время как сам анилин ядовит. Менее ядовиты кислотные производные анилина — анилиды, которые применяются в медицине в качестве жаропонижающих и болеутоляющих средств (антифебрин и др.).
- В статье воспроизведен текст из Малой советской энциклопедии.
См. также
Ссылки
wiki.laser.ru
Общая характеристика олеиновой кислоты
Олеиновая кислота одна из наиболее распространенных в природе непредельных кислот. Встречается в различных растительных маслах и животных жирах. Она не имеет запаха, имеет вид бесцветного масло, хотя коммерческие образцы могут иметь желтоватый оттенок.С химической точки зрения, олеиновая кислота классифицируется как мононенасыщенные омега-9 жирная кислота.
Термин «олеиновый» означает полученный из оливкового масла, которое преимущественно состоит из олеиновой кислоты.
Входит в состав таких растительных масел, как оливковом (около 81%), арахисовое (около 66%), подсолнечное (около 40%). Также распрастранено в животных жирах: в говяжьем жире в пределах от 41 до 42%, в тресковом от 30%, в свином от 37 до 44%).
Синонимы: цис-9-октадеценовая кислота
Сочетает химические свойства карбоновых кислот и олефинов: образует производные по карбоксильной группе, присоединяет водород по двойной связи. При действии сильных окислителей (КМnО4 ; О3) образует пеларгоновой и азелаиновой смесь кислот, что часто применяется для их промышленного получения.
Получение олеиновой кислоты
Получают олеиновую кислоту в промышленном масштабе путем гидролиза масел или жиров с фракционированием образующейся смеси кислот и многократной перекристаллизацией из метанола (90%) или ацетона (при -40 С).
В природе олеиновая кислота образуется путем дегидрирования стеариновой кислоты (аэробный путь в организме животных) или удлинением цепи ненасыщенных жирных кислот (анаэробный путь в микроорганизмах). Наличие олеиновой кислоты в животном жире обеспечивает его защиту от пероксидного окисления.
Применение олеиновой кислоты
Олеиновая кислота и ее эфиры активно используются для получения лакокрасочных материалов, как пластификаторы. Она так же применяется в производстве моющих средств промышленного значения. Широко применяется (в качестве смазывающе-охлаждающих жидкостей) при сверлении и обработке труднообрабатываемых нержавеющих сталей и сплавов. Также олеиновая кислота выступает эмульгатором в резинотехнической промышленности.
В виде его натриевой соли олеиновая кислота является основным компонентом мыла в качестве эмульгирующего агента. Она также используется в качестве эмолента. Небольшие количества олеиновой кислоты используют в качестве наполнителя в фармацевтических препаратов, олеиновую кислоту используют в качестве эмульгатора или солюбилизирующего агента в аэрозолях.
Олеиновая кислота часто применяется в качестве эмульгатора-стабилизатора инвертных эмульсий в инвертно-эмульсионных буровых растворах на нефтяной основе.
Характеристики олеиновой кислоты
| Характеристики | Показатели |
| CAS — номер | 112-80-1 |
| Молекулярная формула | C18H34O2 |
| Молекулярный вес , г/моль | 282.46 |
| Плотность, г/см3 | 0.895 |
| Температура плавления, °C | 13-14 |
| Растворимость в воде (КТ), г/л | — |
Автор: Виктор Епифанов
unibrom.ru