Формула гексафторид серы: Гексафторид серы — это… Что такое Гексафторид серы?
Фторид серы(VI) — Википедия
| Фторид серы | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз |
| Хим. формула | SF6 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 146,06 г/моль |
| Плотность | Газ: 6,164 г/л Жидкость: 1,33 г/см³ |
| Энергия ионизации | |
| Термические свойства | |
| Т. плав. | −50,8 °C |
| −83 ± 1 °F[1] | |
| Т. кип. | сублимация при −63,9 °C |
| Мол. теплоёмк. | 97,15 Дж/(моль·К) |
| Теплопроводность | 0,012058 Вт/(м·K) |
| Энтальпия образования | −1219 кДж/моль |
| Давление пара | 21,5 ± 0,1 атм[1] |
| Структура | |
| Координационная геометрия | октаэдрическая |
| Кристаллическая структура | орторомбическая |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 2551-62-4 |
| PubChem | 17358 |
| Рег. номер EINECS | 219-854-2 |
| SMILES | |
| InChI | |
| RTECS | WS4900000 |
| ChEBI | 30496 |
| Номер ООН | 1080 |
| ChemSpider | 16425 |
| Безопасность | |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
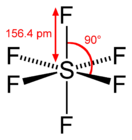
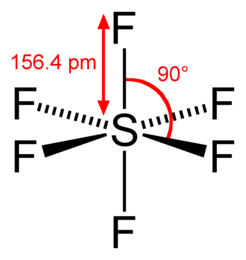
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха). Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Методы получения
Возможно получать гексафторид серы из простых веществ:
- S + 3 F 2 → S F 6 {\displaystyle {\mathsf {S+3F_{2}\rightarrow SF_{6}}}}
Также гексафторид серы образуется при разложении сложных фторидов серы:
- S 2 F 10 → S F 6 + S F 4 {\displaystyle {\mathsf {S_{2}F_{10}\rightarrow SF_{6}+SF_{4}}}}
Физико-химические свойства
Практически бесцветный газ, без запаха и вкуса. Обладает высоким пробивным напряжением (89 кВ/см — примерно в 3 раза выше, чем у воздуха при нормальном давлении).
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этаноле и диэтиловом эфире[2], хорошо растворим в нитрометане.
Плотность элегаза при температуре 273 K и давлении 0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH[4], однако при действии восстановителей могут протекать некоторые реакции.
В составе молекулы газа 21,95 % серы и 78,05 % фтора по массе.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке:
- S F 6 + 8 N a → N a 2 S + 6 N a F {\displaystyle {\mathsf {SF_{6}+8Na\rightarrow Na_{2}S+6NaF}}}
Гексафторид серы реагирует с литием с выделением большого количества тепла:
- S F 6 + 6 L i → S + 6 L i F {\displaystyle {\mathsf {SF_{6}+6Li\rightarrow S+6LiF}}}
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
- 2 S F 6 + 6 H 2 S → S 8 + 12 H F {\displaystyle {\mathsf {2SF_{6}+6H_{2}S\rightarrow S_{8}+12HF}}}
- S F 6 + 8 H I → 6 H F + H 2 S + 4 I 2 {\displaystyle {\mathsf {SF_{6}+8HI\rightarrow 6HF+H_{2}S+4I_{2}}}}
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
- S F 6 + P F 3 → P F 5 + S F 4 {\displaystyle {\mathsf {SF_{6}+PF_{3}\rightarrow PF_{5}+SF_{4}}}}
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[5];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния;
- как окислитель в некоторых экзотических тепловых двигателях — например, в паротурбинной установке американской малогабаритной 324-мм противолодочной торпеды Mark 50, где он используется для окисления металлического лития.
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию гелия[6].
Применение в электротехнике
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[7]. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на Кирово-Чепецком химическом комбинате[8].
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло [9].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др[10]. Также элегаз используется как среда дугогашения в высоковольтных выключателях[11].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей[источник не указан 1903 дня].
Регламентирующие стандарты
IEC
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
EN[en]
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
- Основной источник: [12]
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = 24 900. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется Киотским протоколом.
Интересные факты
- Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой»[13]. Так же, из-за высокой плотности, скорость звука в этом газе значительно ниже, чем в воздухе, что приводит к комичному эффекту при вдыхании газа — голос становится очень низким и грубым, подобно голосу Дарта Вейдера. Опыт также демонстрировался в передаче «Разрушители легенд». Аналогичный эффект создаёт и ксенон. А гелий — который в 6 раз легче воздуха — при вдыхании наоборот создаёт тонкий и писклявый голос.
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0576.html
- ↑ Свойства гексафторида серы на сайте «Химик.ру»
- ↑ 1 2 Sulfur hexafluoride. Air Liquide Gas Encyclopedia. Проверено 22 февраля 2013.
- ↑ Успехи химии, 1975, Том 44, Номер 2, Страницы 193—213.
- ↑ Применение шестифтористой серы
- ↑ Фрагмент передачи «Разрушители мифов»
- ↑ Гохберг Б. М. Ленинградский физико-технический институт Академии наук СССР (рус.) // Успехи физических наук. — 1940. — Т. XXIV, вып. 1. — С. 11-20. См. стр. 16-17, раздел «Электрическая прочность газов»
- ↑ Уткин В. В. Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди. — Киров: ОАО «Дом печати — Вятка», 2007. — Т. 4 (1973—1992), часть 1. — С. 66—67. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
- ↑ Коробейников С.М., д.ф.м.н., профессор. Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков. (рус.). Проверено 2 июня 2011. Архивировано 20 февраля 2012 года.
- ↑ ЗВА :: Измерительные трансформаторы с газовой изоляцией
- ↑ Применение SF6 в высоковольтной электронике.
- ↑ Элегаз. Свойства
- ↑ Выпуск 105. Вирусное видео. 6 сезон
Литература
- Гохберг Б. М. Элегаз — электрическая газовая изоляция (рус.) // «Электричество». — 1947. — № 3. — С. 15.
См. также
Фторид серы(VI) — Википедия
| Фторид серы | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз |
| Хим. формула | SF6 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 146,06 г/моль |
| Плотность | Газ: 6,164 г/л Жидкость: 1,33 г/см³ |
| Энергия ионизации | 19,3 ± 0,1 эВ[1] |
| Термические свойства | |
| Т. плав. | −50,8 °C |
| −83 ± 1 °F[1] | |
| Т. кип. | сублимация при −63,9 °C |
| Мол. теплоёмк. | 97,15 Дж/(моль·К) |
| Теплопроводность | 0,012058 Вт/(м·K) |
| Энтальпия образования | −1219 кДж/моль |
| Давление пара | 21,5 ± 0,1 атм[1] |
| Структура | |
| Координационная геометрия | октаэдрическая |
| Кристаллическая структура | орторомбическая |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 2551-62-4 |
| PubChem | 17358 |
| Рег. номер EINECS | 219-854-2 |
| SMILES | |
| InChI | |
| RTECS | WS4900000 |
| ChEBI | 30496 |
| Номер ООН | 1080 |
| ChemSpider | 16425 |
| Безопасность | |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха). Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Методы получения
Возможно получать гексафторид серы из простых веществ:
- S + 3 F 2 → S F 6 {\displaystyle {\mathsf {S+3F_{2}\rightarrow SF_{6}}}}
Также гексафторид серы образуется при разложении сложных фторидов серы:
- S 2 F 10 → S F 6 + S F 4 {\displaystyle {\mathsf {S_{2}F_{10}\rightarrow SF_{6}+SF_{4}}}}
Физико-химические свойства
Практически бесцветный газ, без запаха и вкуса. Обладает высоким пробивным напряжением (89 кВ/см — примерно в 3 раза выше, чем у воздуха при нормальном давлении).
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этаноле и диэтиловом эфире[2], хорошо растворим в нитрометане.
Плотность элегаза при температуре 273 K и давлении 0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH[4], однако при действии восстановителей могут протекать некоторые реакции.
В составе молекулы газа 21,95 % серы и 78,05 % фтора по массе.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке:
- S F 6 + 8 N a → N a 2 S + 6 N a F {\displaystyle {\mathsf {SF_{6}+8Na\rightarrow Na_{2}S+6NaF}}}
Гексафторид серы реагирует с литием с выделением большого количества тепла:
- S F 6 + 6 L i → S + 6 L i F {\displaystyle {\mathsf {SF_{6}+6Li\rightarrow S+6LiF}}}
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
- 2 S F 6 + 6 H 2 S → S 8 + 12 H F {\displaystyle {\mathsf {2SF_{6}+6H_{2}S\rightarrow S_{8}+12HF}}}
- S F 6 + 8 H I → 6 H F + H 2 S + 4 I 2 {\displaystyle {\mathsf {SF_{6}+8HI\rightarrow 6HF+H_{2}S+4I_{2}}}}
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
- S F 6 + P F 3 → P F 5 + S F 4 {\displaystyle {\mathsf {SF_{6}+PF_{3}\rightarrow PF_{5}+SF_{4}}}}
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[5];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния;
- как окислитель в некоторых экзотических тепловых двигателях — например, в паротурбинной установке американской малогабаритной 324-мм противолодочной торпеды Mark 50, где он используется для окисления металлического лития.
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию гелия[6].
Применение в электротехнике
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[7]. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на Кирово-Чепецком химическом комбинате[8].
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло[9].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др[10]. Также элегаз используется как среда дугогашения в высоковольтных выключателях[11].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей[источник не указан 1903 дня].
Регламентирующие стандарты
IEC
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
EN[en]
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
- Основной источник: [12]
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = 24 900. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется Киотским протоколом.
Интересные факты
- Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой»[13]. Так же, из-за высокой плотности, скорость звука в этом газе значительно ниже, чем в воздухе, что приводит к комичному эффекту при вдыхании газа — голос становится очень низким и грубым, подобно голосу Дарта Вейдера. Опыт также демонстрировался в передаче «Разрушители легенд». Аналогичный эффект создаёт и ксенон. А гелий — который в 6 раз легче воздуха — при вдыхании наоборот создаёт тонкий и писклявый голос.
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0576.html
- ↑ Свойства гексафторида серы на сайте «Химик.ру»
- ↑ 1 2 Sulfur hexafluoride. Air Liquide Gas Encyclopedia. Проверено 22 февраля 2013.
- ↑ Успехи химии, 1975, Том 44, Номер 2, Страницы 193—213.
- ↑ Применение шестифтористой серы
- ↑ Фрагмент передачи «Разрушители мифов»
- ↑ Гохберг Б. М. Ленинградский физико-технический институт Академии наук СССР (рус.) // Успехи физических наук. — 1940. — Т. XXIV, вып. 1. — С. 11-20. См. стр. 16-17, раздел «Электрическая прочность газов»
- ↑ Уткин В. В. Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди. — Киров: ОАО «Дом печати — Вятка», 2007. — Т. 4 (1973—1992), часть 1. — С. 66—67. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
- ↑ Коробейников С.М., д.ф.м.н., профессор. Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков. (рус.). Проверено 2 июня 2011. Архивировано 20 февраля 2012 года.
- ↑ ЗВА :: Измерительные трансформаторы с газовой изоляцией
- ↑ Применение SF6 в высоковольтной электронике.
- ↑ Элегаз. Свойства
- ↑ Выпуск 105. Вирусное видео. 6 сезон
Литература
- Гохберг Б. М. Элегаз — электрическая газовая изоляция (рус.) // «Электричество». — 1947. — № 3. — С. 15.
См. также
Фторид серы(VI) — это… Что такое Фторид серы(VI)?
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при нормальных условиях тяжёлый газ, в 5 раз тяжелее воздуха. Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Методы получения
Возможно получать гексафторид серы из простых веществ:
Также гексафторид серы образуется при разложении сложных фторидов серы:
Физико-химические свойства
Практически бесцветный газ, обладающий высоким (89 кВ/см) пробивным напряжением. Электрическая прочность элегаза зависит от давления, она в 2-4 раза выше, чем у воздуха.
В нем содержится 21,95 % серы и 78,05 % фтора. При нормальном давлении элегаз может находиться в любом из трёх агрегатных состояний при температуре до минус 50,8 °С.
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этиловом спирте и диэтиловом эфире[1], хорошо растворим в нитрометане[2].
Плотность элегаза при T=273 K и давлении р=0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно из-за кинетических факторов, так как свободная энергия Гиббса реакции существенно отрицательна. Не реагирует также с растворами HCl и NaOH[3], однако при действии восстановителей могут протекать некоторые реакции.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке.
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости;[4];
- для изменения тембра голосовых связок (эффект пониженной тональности голоса), противоположно гелию[5];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния.
- в термодинамике. При добавлении в состав рабочего тела вертикальной тепловой трубы занимает пространство между жидкостью и паром рабочего тела, снижает парциальное давление паров на жидкость и обеспечивает принудительное удаление паров от поверхности жидкости при температурах ниже температуры кипения; обеспечивает конденсацию паров при повышенных температурах, придавая тепловой трубе свойства самодействующего теплового насоса. Патент Украины № 97882.
Применение в электротехнике
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[6]. Электрическая прочность при атмосферном давлении и зазоре 1 см составляет Е=89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло[7].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5-7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др.[8] Также элегаз используется как среда дугогашения в высоковольтных выключателях[9].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей.
Регламентирующие стандарты
IEC
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на ее повторное использование.
EN
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
- Основной источник: [10]
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Потенциал разрушения озонового слоя ODP = 0
Потенциал глобального потепления GWP = 24 900 (регламентируется Киотским протоколом).
Интересные факты
- Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда), и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой» (Выпуск 105. Вирусное видео. 7 сезон.)
- Если вдохнуть в себя гексафторид серы, то голос станет низким (действие, противоположное действию гелия).
Примечания
Литература
- Гохберг Б. М. Элегаз — электрическая газовая изоляция (рус.) // «Электричество». — 1947. — № 3. — С. 15.
См. также
| Фторид серы(VI) | |||
|---|---|---|---|
| |||
| Систематическое наименование | Фторид серы(VI) | ||
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз | ||
| Хим. формула | SF6 | ||
| Рац. формула | SF6 | ||
| Состояние | газ | ||
| Молярная масса | 146,06 г/моль | ||
| Плотность | Газ: 6,164 г/л Жидкость: 1,33 г/см³ | ||
| Энергия ионизации | 19,3 ± 0,1 эВ[1] | ||
| Температура | |||
| • плавления | −50,8 °C | ||
| • сублимации | −83 ± 1 °F[1] | ||
| • кипения | сублимация при −63,9 °C | ||
| Мол. теплоёмк. | 97,15 Дж/(моль·К) | ||
| Теплопроводность | 0,012058 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | −1219 кДж/моль | ||
| Давление пара | 21,5 ± 0,1 атм[1] | ||
| Координационная геометрия | октаэдрическая | ||
| Кристаллическая структура | орторомбическая | ||
| Дипольный момент | 0 Д | ||
| Рег. номер CAS | 2551-62-4 | ||
| PubChem | 17358 | ||
| Рег. номер EINECS | 219-854-2 | ||
| SMILES | |||
Фторид серы(VI) — Википедия. Что такое Фторид серы(VI)
| Фторид серы | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз |
| Хим. формула | SF6 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 146,06 г/моль |
| Плотность | Газ: 6,164 г/л Жидкость: 1,33 г/см³ |
| Энергия ионизации | 19,3 ± 0,1 эВ[1] |
| Термические свойства | |
| Т. плав. | −50,8 °C |
| −83 ± 1 °F[1] | |
| Т. кип. | сублимация при −63,9 °C |
| Мол. теплоёмк. | 97,15 Дж/(моль·К) |
| Теплопроводность | 0,012058 Вт/(м·K) |
| Энтальпия образования | −1219 кДж/моль |
| Давление пара | 21,5 ± 0,1 атм[1] |
| Структура | |
| Координационная геометрия | октаэдрическая |
| Кристаллическая структура | орторомбическая |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 2551-62-4 |
| PubChem | 17358 |
| Рег. номер EINECS | 219-854-2 |
| SMILES | |
| InChI | |
| RTECS | WS4900000 |
| ChEBI | 30496 |
| Номер ООН | 1080 |
| ChemSpider | 16425 |
| Безопасность | |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха). Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Методы получения
Возможно получать гексафторид серы из простых веществ:
- S + 3 F 2 → S F 6 {\displaystyle {\mathsf {S+3F_{2}\rightarrow SF_{6}}}}
Также гексафторид серы образуется при разложении сложных фторидов серы:
- S 2 F 10 → S F 6 + S F 4 {\displaystyle {\mathsf {S_{2}F_{10}\rightarrow SF_{6}+SF_{4}}}}
Физико-химические свойства
Практически бесцветный газ, без запаха и вкуса. Обладает высоким пробивным напряжением (89 кВ/см — примерно в 3 раза выше, чем у воздуха при нормальном давлении).
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этаноле и диэтиловом эфире[2], хорошо растворим в нитрометане.
Плотность элегаза при температуре 273 K и давлении 0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH[4], однако при действии восстановителей могут протекать некоторые реакции.
В составе молекулы газа 21,95 % серы и 78,05 % фтора по массе.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке:
- S F 6 + 8 N a → N a 2 S + 6 N a F {\displaystyle {\mathsf {SF_{6}+8Na\rightarrow Na_{2}S+6NaF}}}
Гексафторид серы реагирует с литием с выделением большого количества тепла:
- S F 6 + 6 L i → S + 6 L i F {\displaystyle {\mathsf {SF_{6}+6Li\rightarrow S+6LiF}}}
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
- 2 S F 6 + 6 H 2 S → S 8 + 12 H F {\displaystyle {\mathsf {2SF_{6}+6H_{2}S\rightarrow S_{8}+12HF}}}
- S F 6 + 8 H I → 6 H F + H 2 S + 4 I 2 {\displaystyle {\mathsf {SF_{6}+8HI\rightarrow 6HF+H_{2}S+4I_{2}}}}
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
- S F 6 + P F 3 → P F 5 + S F 4 {\displaystyle {\mathsf {SF_{6}+PF_{3}\rightarrow PF_{5}+SF_{4}}}}
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[5];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния;
- как окислитель в некоторых экзотических тепловых двигателях — например, в паротурбинной установке американской малогабаритной 324-мм противолодочной торпеды Mark 50, где он используется для окисления металлического лития.
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию гелия[6].
Применение в электротехнике
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[7]. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на Кирово-Чепецком химическом комбинате[8].
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло[9].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др[10]. Также элегаз используется как среда дугогашения в высоковольтных выключателях[11].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей[источник не указан 1903 дня].
Регламентирующие стандарты
IEC
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
EN[en]
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
- Основной источник: [12]
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = 24 900. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется Киотским протоколом.
Интересные факты
- Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой»[13]. Так же, из-за высокой плотности, скорость звука в этом газе значительно ниже, чем в воздухе, что приводит к комичному эффекту при вдыхании газа — голос становится очень низким и грубым, подобно голосу Дарта Вейдера. Опыт также демонстрировался в передаче «Разрушители легенд». Аналогичный эффект создаёт и ксенон. А гелий — который в 6 раз легче воздуха — при вдыхании наоборот создаёт тонкий и писклявый голос.
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0576.html
- ↑ Свойства гексафторида серы на сайте «Химик.ру»
- ↑ 1 2 Sulfur hexafluoride. Air Liquide Gas Encyclopedia. Проверено 22 февраля 2013.
- ↑ Успехи химии, 1975, Том 44, Номер 2, Страницы 193—213.
- ↑ Применение шестифтористой серы
- ↑ Фрагмент передачи «Разрушители мифов»
- ↑ Гохберг Б. М. Ленинградский физико-технический институт Академии наук СССР (рус.) // Успехи физических наук. — 1940. — Т. XXIV, вып. 1. — С. 11-20. См. стр. 16-17, раздел «Электрическая прочность газов»
- ↑ Уткин В. В. Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди. — Киров: ОАО «Дом печати — Вятка», 2007. — Т. 4 (1973—1992), часть 1. — С. 66—67. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
- ↑ Коробейников С.М., д.ф.м.н., профессор. Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков. (рус.). Проверено 2 июня 2011. Архивировано 20 февраля 2012 года.
- ↑ ЗВА :: Измерительные трансформаторы с газовой изоляцией
- ↑ Применение SF6 в высоковольтной электронике.
- ↑ Элегаз. Свойства
- ↑ Выпуск 105. Вирусное видео. 6 сезон
Литература
- Гохберг Б. М. Элегаз — электрическая газовая изоляция (рус.) // «Электричество». — 1947. — № 3. — С. 15.
См. также
Гексафторид серы
А Вы знаете, что такое гексафторид серы и где он применяется?
Гексафторид серы.Сера гексафторид | Свойства газа SF6
История SF6
Газы SF6 или серы гексафторида объединяются одной серой и шестью атомами фтора. Этот газ был впервые реализован в 1900 году в лабораториях Факультета фармации де Пари в Париже.
В 1937 году General Electric Company впервые осознала, что газ SF6, то есть гексафторид серы, может использоваться в качестве изоляционного материала. После Второй мировой войны, т. е. в середине 20-го века, популярность использования гексафторида серы в качестве изоляционного материала в электрической системе стремительно возрастала.
Allied Chemical Corporation и Pennsalt были первыми американскими промышленными предприятиями, которые начали производить этот газ коммерчески в 1948 году. В течение 1960 года популярность использовала гексафторид серы в высоковольтных распределительных устройствах. Поскольку спрос на этот газ увеличивался, многие производители в Европе и Америке начали производить газ SF6 в больших масштабах за это время.
Вначале газ гексафторида серы используется только для изоляции в электрической системе. Но вскоре выяснилось, что этот газ обладает огромным дугогасящим свойством. Следовательно, этот газ также начал использоваться в автоматическом выключателе в качестве дуговой закалочной среды.
Первая в мире SF6-газоизолированная подстанция была создана в Париже в 1966 году. Выключатели среднего напряжения на основе гексафторида серы начали выпускаться с 1971 года.
Изготовление газа гексафторида серы
SF6 или гексафторид серы коммерчески получают реакцией фтора (полученного электролизом) с серой. В процессе производства этого газа другие продукты, такие как SF4, SF2, S2F2, S2F10, также производятся в небольших процентах. В производстве также присутствуют не только эти побочные продукты, такие как воздух, влажность, CO2. Все эти побочные продукты и примеси фильтруются на разных стадиях очистки, чтобы получить чистый и доводят конечный продукт.
Химические свойства гексафторида серы
Для изучения химических свойств гексафторида серы серы сначала вводим структуру этой молекулы. В этом газе молекула один атом серы окружен шестью атомами фтора.
Сера имеет атомное число 16. Это означает, что она имеет 2 электрона в первом энергетическом уровне, 8 электронов во втором энергетическом уровне и остальные 6 электронов на третьем уровне энергии. Электронная конфигурация атома серы равна 2, 8, 6, т.е. 1S2 2S2 2P6 3S2 3P4.
Атом фтора имеет атомный номер 9. Электронная конфигурация фтора равна 1S2 2S2 2P5.
Каждый атом серы в молекуле SF6 создает ковалентную связь с 6 атомами фтора. Таким образом, атом серы получает полные 6 ковалентных связей, то есть 6 пар электронов на его внешней оболочке, и каждый атом цветения получает 8 электронов в своей внешней оболочке.
Н. Б.: Здесь мы можем заметить, что в гексафториде серы внешняя оболочка атома серы имеет 12 электронов вместо 8 электронов. Это означает, что здесь серу не подчиняется общему восьмеричному правилу атомной структуры, в котором говорится, что стабильный атом требует 8 электронов на своей внешней оболочке. Это не исключительный случай. Некоторые элементы в 3-м периоде и ниже могут образовывать соединение, которое превышает 8 электронов в его внешней оболочке.
Таким образом, гексафторид серы полностью удовлетворяет стабильным структурным условиям. Эффективный радиус молекулы гексафторида серы составляет 2,385 А. Эта исключительная электронная конфигурация и структура этого газа делают SF6 чрезвычайно устойчивым. Газ может быть стабильным без какого-либо разложения в его молекулярной структуре до 500oC. Он очень невоспламеняющийся. h3O и Cl не могут реагировать с этим газом. Он также не реагирует с кислотой.
Газ SF6 является одним из самых тяжелых газов. Плотность этого газа при 20oC при одном атмосферном давлении составляет около 6,139 кг / м3, что примерно в 5 раз выше, чем воздух при тех же условиях. Молекулярная масса этого газа составляет 146,06.
Изменение давления с температурой является линейным для гексафторида серы и оно мало в пределах рабочей температуры, то есть от -25 до + 50oC.
Объемная удельная теплоемкость этого газа также высока. Это примерно в 3,7 раза больше, чем воздуха, и именно поэтому этот газ также обладает огромным охлаждающим эффектом в электрооборудовании. Теплопроводность этого газа не очень высока, она даже ниже, чем воздух.
Тем не менее он вполне подходит для охлаждения в автоматическом выключателе. Это связано с тем, что во время диссоциации молекул гексафторида серы вокруг электрической дуги эти молекулы поглощают большое количество тепла. Затем это тепло высвобождается, когда молекулы реконструируются на периферии дуги. Этот процесс помогает очень быстро перевести тепло от жаркого сезона в прохладный сезон.
Поэтому; этот газ обладает отличным охлаждающим эффектом при высокой температуре, хотя теплопроводность SF6 не очень велика.
Электрические свойства газа SF6
Газ SF6 обладает высокой электроотрицательностью. Из-за высокой электроотрицательности он поглощает свободные электроны, которые возникают из-за дуги между контактами автоматического выключателя. Сочетание свободных электронов с молекулами дает тяжелые и большие ионы, которые имеют очень низкую подвижность. Из-за поглощения свободных электронов и низкой подвижности ионов гексафторид серы обладает очень отличным диэлектрическим свойством. Диэлектрическая прочность газа гексафторида серы примерно в 2,5 раза больше, чем у воздуха.
| Фторид серы(VI) | |||
|---|---|---|---|
| |||
| Систематическое наименование | Фторид серы(VI) | ||
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз | ||
| Хим. формула | SF6 | ||
| Рац. формула | SF6 | ||
| Состояние | газ | ||
| Молярная масса | 146,06 г/моль | ||
| Плотность | Газ: 6,164 г/л Жидкость: 1,33 г/см³ | ||
| Энергия ионизации | 19,3 ± 0,1 эВ[1] | ||
| Температура | |||
| • плавления | −50,8 °C | ||
| • сублимации | −83 ± 1 °F[1] | ||
| • кипения | сублимация при −63,9 °C | ||
| Мол. теплоёмк. | 97,15 Дж/(моль·К) | ||
| Теплопроводность | 0,012058 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | −1219 кДж/моль | ||
| Давление пара | 21,5 ± 0,1 атм[1] | ||
| Координационная геометрия | октаэдрическая | ||
| Кристаллическая структура | орторомбическая | ||
| Дипольный момент | 0 Д | ||
| Рег. номер CAS | 2551-62-4 | ||
| PubChem | 17358 | ||
| Рег. номер EINECS | 219-854-2 | ||
| SMILES | |||
| InChI | |||
Формула гексафторида серы
Формула и структура: Химическая формула гексафторида серы SF 6 , а его молярная масса составляет 146,00554 г / моль -1 . Структура гексафторида серы — октаэдр, с 6 атомами фтора, связанными с центральным атомом серы. Каждая связь S-F имеет угол 90º. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происхождение: Газообразный гексафторид серы и другие газы S x F y не были свободно произведены природой.Однако в наши дни они обнаруживаются в атмосфере как часть парниковых газов.
Получение: Гексафторид серы синтезируют путем выдержки элементарной серы (твердое кристаллическое вещество S 8 ) и элементарного фтора (газ F 2 ) при 300 ºC. После завершения реакции SF 6 очищают нагреванием или промывкой щелочью для удаления других газов S x F y .
1 / 8S 8 + 3F 2 → SF 6
Физические свойства: гексафторид серы — это бесцветный газ без вкуса и запаха.SF6 негорючий, в шесть раз тяжелее воздуха, его плотность 6,602 г / мл -1 . Его температура кипения составляет -64 ºC. Он слабо растворяется в воде и других полярных растворителях. Гексафторид серы поставляется в виде сжиженного газа.
Химические свойства: Несмотря на то, что гексафторид серы имеет 6 атомов фтора, который является наиболее электроотрицательным атомом в периодической таблице, его дипольный момент равен 0. Это связано с тем, что октаэдрическая геометрия допускает отмену всех диполей, связанных с шестью связями S-F.Следовательно, гексафторид серы представляет собой неполярную молекулу, которая слабо растворяется в полярных соединениях. Другой важный факт о химии SF 6 : это очень стабильное соединение, поэтому оно не может быть присоединено другими химическими соединениями и может присутствовать в атмосфере в течение многих десятилетий, что является экологической проблемой.
Области применения: Гексафторид серы широко используется в качестве диэлектрической среды при производстве электрического оборудования благодаря своей высокой относительной диэлектрической проницаемости.Магниевая промышленность является вторым по величине потребителем гексафторида серы, где он работает как газ для заполнения литейных форм. Таким образом, SF 6 находит широкое применение в медицине, где он используется при операциях на сетчатке для восстановления камеры стекловидного тела. Кроме того, гексафторид серы вводится в качестве контрастного вещества для ультразвуковой визуализации.
Воздействие на здоровье / опасность для здоровья: гексафторид серы не токсичен, однако он может быть опасен при вдыхании большого количества газа и может привести к асфиксии.SF 6 является наиболее сильным парниковым газом (газ, вызывающий глобальное потепление) из-за его длительного срока службы и способности поглощать или излучать радиацию в атмосфере.
.Гексафторид серы — Простая английская Википедия, свободная энциклопедия
Гексафторид серы , также известный как фторид серы (VI) , представляет собой химическое соединение. Его химическая формула — SF 6 . Он содержит серу в степени окисления +6. Он также содержит ионы фтора.
BBC News сообщает: «Это самый мощный парниковый газ, известный человечеству, и в последние годы резко выросли выбросы. Гексафторид серы, или SF6, широко используется в электротехнической промышленности для предотвращения коротких замыканий и аварий.Утечки малоизвестного газа в Великобритании и других странах ЕС в 2017 году были равносильны выводу на дороги еще 1,3 миллиона автомобилей «. [1]
Гексафторид серы — это бесцветный газ без запаха. Это очень тяжело для газа (примерно в 5 раз тяжелее воздуха). [2] [3] Он не реагирует, и трудно найти что-либо, что с ним взаимодействует. Это сильный парниковый газ. Это заставило людей наложить некоторые ограничения на его использование.
Его получают в результате реакции серы с фтором.Эта комбинация также образует токсичный декафторид дисеры, который необходимо удалить.

Применяется в электронике и различных электрических устройствах. Его можно использовать в организме, поскольку он не токсичен. Его можно использовать в качестве испытательного газа, например, чтобы посмотреть, где течет газ в системе обогрева. Обнаруживается легко. Используется в некоторых торпедах. Литий — одно из немногих веществ, которое вступает в реакцию с гексафторидом серы. Гексафторид серы распыляется на литий. Это делает литий очень горячим.Он создает пар из воды и стреляет в торпеду. Его можно вдохнуть, чтобы сделать голос глубже. Это противоположно вдыханию газообразного гелия.
Гексафторид серы не токсичен. Однако он может заполнять закрытые пространства. Человек может задохнуться в закрытом помещении, если гексафторид серы вытеснил кислород из помещения.
 Таймсериал гексафторида серы Мауна-Лоа.
Таймсериал гексафторида серы Мауна-Лоа. Согласно Межправительственной группе экспертов по изменению климата, SF
6 является наиболее сильным парниковым газом, который она оценила, с потенциалом глобального потепления (GWP) в 22,800 [4] раз выше, чем CO
2 при сравнении за 100-летний период.Измерения SF 6 показывают, что его глобальное среднее соотношение смешивания увеличивалось примерно на 0,2 п.п. в год до более 7 п.п. [5] Гексафторид серы также чрезвычайно долгоживущий. Он инертен в тропосфере и стратосфере. Расчетная продолжительность жизни в атмосфере составляет 800–3200 лет. [6] SF
6 очень стабильный. (Для стран, сообщающих о своих выбросах в РКИК ООН, ПГП в размере 23 900 для SF
6 был предложен на третьей Конференции Сторон: ПГП используется в Киотском протоколе). [7] Средние глобальные концентрации SF 6 увеличивались примерно на семь процентов в год в течение 1980-х и 1990-х годов, в основном в результате его использования в промышленности по производству магния, а также производителями электрооборудования и электроники. Принимая во внимание небольшое количество выбросов SF 6 по сравнению с двуокисью углерода, его общий вклад в глобальное потепление оценивается менее чем на 0,2 процента. [источник ? ]
В Европе SF
6 подпадает под действие директивы по фторсодержащим газам, которая запрещает или контролирует его использование несколькими способами.С 1 января 2006 года SF
6 запрещен в качестве индикаторного газа для всех применений, кроме высоковольтных распределительных устройств. [8]
Молекулярная масса гексафторида серы
Молярная масса of SF6 = 146,0554192 г / моль
Перевести граммы гексафторида серы в моль или моль гексафторида серы в граммы
Расчет молекулярной массы:
32.065 + 18.9984032 * 6
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| фтор | F | 18.9984032 | 6 | 78,046% |
| Сера | S | 32.065 | 1 | 21,954% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий.Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Если формула, используемая при вычислении молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества.Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции.Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
,Гексафторид серы — CreationWiki, энциклопедия науки о сотворении
Гексафторид серы — очень интересный газ, который имеет множество свойств и применений, которые делают определенные работы более легкими, а в некоторых случаях менее опасными. Гексафторид серы — это синтетический газ, который был открыт в 1901 году. Открытие гексафторида серы в некоторых случаях изменило медицинскую и электрическую промышленность. Были и другие вещи, которые без гексафторида серы были бы невозможны.
Недвижимость
Химическая промышленность
Гексафторид серы или SF6 — это инертный неорганический газ без цвета и запаха, у которого один атом серы окружен шестью атомами фтора. Гексафторид серы — один из самых стабильных газов, он может оставаться стабильным до 500 градусов Цельсия.
Физический
Гексафторид серы — это невидимый газ, который также является одним из самых тяжелых газов. Он примерно в шесть раз тяжелее воздуха. Из-за того, что гексафторид серы является инертным газом, который безопасно вдыхать, и что он в шесть раз тяжелее воздуха, если вы вдыхаете, его голос становится очень низким и неестественным.Гексафторид серы также известен как противоположность гелия.
Синтез / вхождения

Гексафторид серы получают синтетическим путем путем соединения одного атома серы с шестью атомами фтора. Гексафторид серы — это неорганический газ, который не встречается в природе.
использует
Гексафторид серы используется в качестве тестового газа в респираторной психологии, а также в качестве контрастного вещества в ультразвуковых исследованиях. Во время ультразвукового исследования газ распределяется по легким для получения более четкого изображения.Этот газ обычно используется в качестве наполнителя между стеклами в изолированном окне. Он также используется для литья магния. В электротехнической промышленности гексафторид серы используется, когда электрик не хочет, чтобы дуга двигалась в одном темпе к другой из-за его способности блокировать поток электричества в воздухе.
Другое

Если большой контейнер заполнен гексафторидом серы, то легкая лодка из алюминиевой фольги может плавать по газу, создавая впечатление, что лодка плывет ни на чем.
Видео
Описание видео здесь ….
Список литературы
[1] [2] [3]
,